Mit der Technischen Dokumentation weisen Sie als Hersteller die Konformität Ihres In-vitro-Diagnostikums mit der europäischen Verordnung, der IVDR , nach. Im Anhang II der EU-Verordnung 2017/746 über In-vitro-Diagnostika (IVDR) sind diese Anforderungen in sechs Kapitel gegliedert, hinzu kommen noch die Anforderungen aus Anhang III zur Überwachung nach dem Inverkehrbringen. Die Anforderungen sind im Vergleich zu den vorherigen Anforderungen der IVDD sehr umfangreich.Neu ist auch die erweiterte Regelung der Verantwortlichkeiten: Zu den wichtigsten Stakeholdern gehören neben den Herstellern auch Importeure und Händler.Die Inhalte der Technischen Dokumentation (TD) müssen zusammengetragen werden und geforderte, fehlende Leistungsdaten, zur Verifizierung und/oder Validierung Ihres Produktes müssen eingeholt werden. Für Legacy Devices (Bestandsprodukte) hängt der Aufwand von der Güte und der Vollständigkeit der bereits vorliegenden Datenlage ab. Eine Bewertung der vorliegenden Daten ist daher einer der ersten Schritte für die Vorbereitungen zur Zulassung Ihres Produktes auf dem europäischen Markt.
Die IVD-Verordnung IVDR hält viele Neuerungen für Medizinprodukte-Hersteller bereit. Unsere kostenlose Vorlage "Die Technische Dokumentation unter der IVDR" unterstützt Sie bei der Anpassung Ihrer Produktakte.
Die IVDR-Neuerungen stellen wir Ihnen jetzt kostenlos als PDF-Download zur Verfügung. Nutzen Sie unser Whitepaper "Die Technische Dokumentation unter der IVDR" als Vorlage und Checkliste für Ihre IVDR-Anpassung!IVD-Klassifizierung
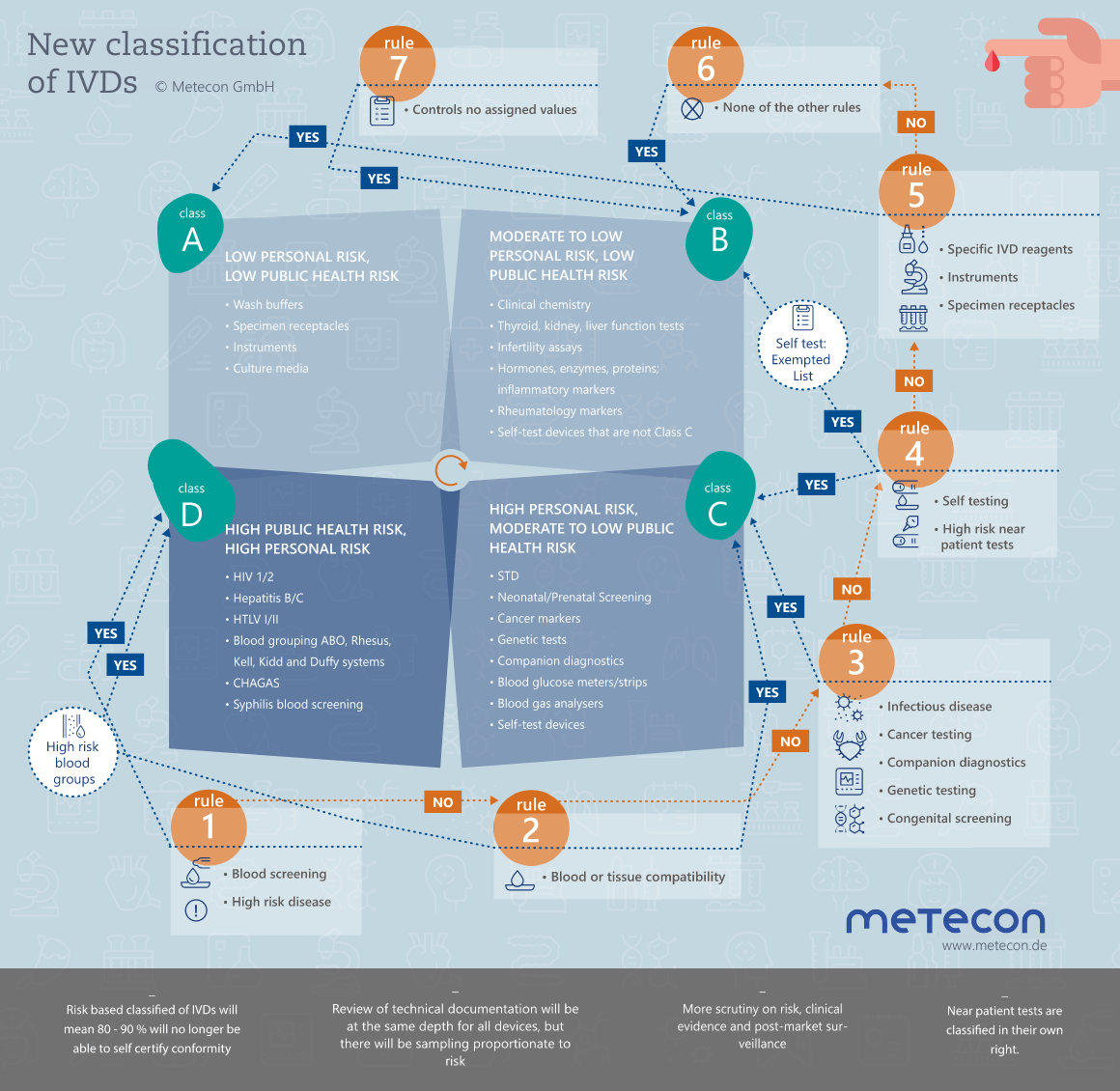
Unter der IVD-Richtlinie waren die Produkte nach Anhang II eingeteilt in Liste A- oder B-Produkte, bzw. in Produkte zur Eigenanwendung und in Sonstige. Neu mit Einführung der Verordnung IVDR erfolgt eine auf sieben Klassifizierungsregeln basierende Einteilung in die Klassen A, B, C oder D. In Abhängigkeit von der Klassifizierung des In-vitro-Diagnostikums (IVD) sind unterschiedliche Vorgaben zum Konformitätsbewertungsverfahren und der Einbindung der Benannten Stelle zu beachten.
Hier finden Sie mehr zu den Klassifizierungsregeln.
Ihre Vorteile aus der Zusammenarbeit mit uns
- Wir sind Ihr verlässlicher Partner bei der Erstellung und Überarbeitung der Technischen Dokumentation Ihrer IVD gemäß IVDR.
- Sie erhalten alle Dokumente für Ihre Technische Dokumentation unterschriftsreif auf Ihren Vorlagen für die Zulassung (international) bzw. Produktzertifizierung (EU).
- Unsere Erfahrung sowohl in der Dokumentation und dem Zertifizierungsprozess als auch in der Verifikation und Validierung ist Garant dafür, dass wir Ihre Ziele schnell und effizient erreichen.
- Unsere GAP-Analysen liefern Handlungsempfehlungen auf allen Ebenen Ihrer regulatorischen Aktivitäten (QM-System, Technische Dokumentation, Produktportfolio).
- Profitieren Sie von unserem Netzwerk. Wir unterstützen Sie bei der Suche nach einer Benannten Stelle, geeigneten Laboren für analytische Testungen, bei der Identifizierung von Probenlieferanten, bei der Antragsstellung für klinische Studien (BfArM, Ethikkommission), bei der Suche einer geeigneten CRO oder einem Usability Labor.
Überdies bieten wir Ihnen Beratung und Unterstützung bei:
- Risikomanagementprozess nach ISO 14971,
- Gebrauchstauglichkeit nach ISO 62366,
- Softwareentwicklungsprozess nach IEC 62304,
- Klinische Leistungsstudien nach ISO 20916,
- Verifizierung und Validierung ihrer Produkte.

Dunja Schildge-Reichmann
Head of Regulatory Affairs & Quality Management
dunja.schildge-reichmann@metecon.de
IVD-Klassifizierung: Wo alles beginnt
Haben Sie bereits Ihre Produkte gemäß den neuen Klassifizierungsregeln der IVDR, Anhang VIII, in die Klassen A, B, C oder D eingestuft? Sicherlich nicht immer einfach und daher raten wir Ihnen, das "MDCG 2020-16 Rev.2 - Guidance on Classification Rules for in vitro Diagnostic Medical Devices under Regulation (EU) 2017/746" vom Februar 2023 bei Bedarf zu Rate zu ziehen.Vorab sollten sie selbstverständlich sicher sein, dass es sich bei den betreffenden Produkten auch um In-vitro Diagnostika handelt. Die Differenzierung zwischen einem Medizinprodukt und einem In-vitro-Diagnostikum (IVD), oder auch zwischen einem IVD und Laborzubehör, fällt nicht immer leicht. Hilfreich ist hier das "Manual on borderline and classification for medical devices under Regulation (EU) 2017/745 on medical devices and Regulation (EU) 2017/746 on in vitro diagnostic medical devices". Achten Sie auf die Aktualität des Manuals, da sich von Zeit zu Zeit Neuerungen ergeben.Für die Definition bzw. Festlegung Ihres Produktes als IVD sowie für dessen Klassifizierung ist die Zweckbestimmung vorausgesetzt. Klären Sie die wichtigen Fragen vorab: Was kann/soll mein Produkt können? Wer ist der Anwender? Wer der Nutznießer? Gibt es Einschränkungen? - Das klingt einfacher, als es ist.Benötigen Sie Unterstützung bei der Klassifizierung Ihrer IVD? Wir freuen uns darauf, gemeinsam eine Lösung für Ihre Produkte zu finden.