In-house IVD unter der IVDR: Handlungsbedarf für medizinische Labore
03.06.2025
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
Mit der In Vitro Diagnostic Medical Device Regulation (Verordnung (EU) 2017/746 (IVDR)) mit Geltungsbeginn am 26. Mai 2022 sind auch hausinterne In-vitro-Diagnostika - sogenannte In-house IVD oder LDTs (laboratory developed tests) - in den Fokus einer strengeren regulatorischen Kontrolle gerückt. Viele medizinische Labore in Europa stehen nun vor der Herausforderung, diese Produkte normkonform weiter betreiben zu können. Was bisher weitgehend unter dem Radar lief, ist heute an umfangreiche Anforderungen geknüpft: vom Risikomanagement über die Leistungsbewertung bis zur Marktverfügbarkeitsprüfung ab 2030: Welche Anforderungen müssen medizinische Labore schon heute für ihre hausinternen Produkte erfüllen? Welche Tests dürfen überhaupt noch als In-house IVD hergestellt und verwendet werden? In diesem Beitrag geben wir einen praxisnahen Überblick über die geltenden Pflichten – und zeigen, worauf Labore jetzt achten sollten, um ihre In-house IVDs rechtskonform und langfristig einsetzbar zu halten.
Die Erfüllung des Anhang I ist zwar keine neue Anforderung für In-house IVD-Hersteller in Deutschland, denn dies war auch schon vor der IVDR durch das vorherige deutsche Gesetz über Medizinprodukte (Medizinproduktegesetz – MPG) gefordert. Allerdings ist dies eine der aufwändigsten Anforderungen an die Hersteller von In-house IVD: Um die Anforderungen des Anhang I zu erfüllen, müssen viele Nachweise und Dokumente erstellt werden, ähnlich derer für die Erstellung einer Technischen Dokumentation von CE-markierten IVD. Außerdem „verstecken“ sich im Anhang I u.a. die Forderung eines produktspezifischen Risikomanagements, der Betrachtung der Gebrauchstauglichkeit und der Durchführung einer Leistungsbewertung.Auch die beiden anderen Forderungen, dass In-house IVD nicht in Verkehr gebracht und nicht im industriellen Maßstab hergestellt werden dürfen, sowie die Forderung nach einem geeigneten Qualitätsmanagement-System (QMS - siehe nächster Absatz) sind nicht neu, sondern waren durch das MPG bereits gefordert.
Anmerkung: Viele Labore arbeiten bereits nach EN ISO 15189, die allerdings keine Anforderungen an Entwicklung und Herstellung abdeckt. Für diese Aspekte empfiehlt sich eine Ergänzung durch relevante Kapitel der ISO 13485. Weitere Orientierung bieten die MDCG-Leitlinie 2023-1 zur Anwendung von Artikel 5(5) sowie – ergänzend – die neue ISO 5649:2024 zur Konzeption und Anwendung laborentwickelter Tests (LDTs). Auch wenn Letztere keine gesetzliche Verbindlichkeit besitzt, kann sie wertvolle Hinweise für die Praxis bieten.Wichtig für Klasse D-Produkte: Die Forderung einer in Bezug auf Herstellung, Design und Leistung detaillierten Dokumentation für Klasse D-Produkte hebt das Niveau der Technischen Dokumentation für In-house Hochrisiko-IVD noch weiter in Richtung CE-markierte IVD an.
Die Erfüllung dieser Anforderung erfordert die Recherche der auf dem Markt befindlichen, gleichartigen CE-markierten Produkte.Für eine solche Recherche könnte u.a. die EUDAMED Datenbank genutzt werden. Als In-house IVD-Hersteller bzw. als Labor sollten Sie die Zeit, bis zur Deadline Ende 2030 sinnvoll nutzen, um geeignete Strategien für die Fortführung Ihrer In-house Produkte zu entwickeln, denn diese Anforderung stellt eine echte Herausforderung dar. Sie könnte dazu führen, dass die Labore viele ihrer hausinternen Produkte ab Dez 2030 nicht mehr verwenden können.Mögliche Szenarien:
Vor allem aufgrund des letzten Punktes besteht die Gefahr, dass viele In-house IVD in Zukunft nicht mehr hergestellt und verwendet werden dürfen. Zudem könnten viele Hersteller von In-house IVD den hohen Dokumentationsaufwand gerade für komplexe Produkte oder Produkte mit Risikoklasse D scheuen, mit der Konsequenz, dass diese dann nicht mehr hergestellt werden und verfügbar sind.Nationale Unterschiede
Die IVDR räumt den Mitgliedsstaaten das Recht ein, über die nationale Gesetzgebung noch weitere Anforderungen an In-house IVD stellen zu können, und auch die Herstellung und die Verwendung bestimmter Arten von In-house IVD können eingeschränkt werden. Die einzelnen EU-Mitgliedsstaaten können bspw. die Anforderung zur detaillierten Dokumentation auch auf die Produktklassen A, B und C erweitern (siehe auch MPDG §88 (1) 10.). Bisher ist z. B. in Deutschland aber noch keine entsprechende Verordnung verabschiedet worden, die zusätzliche Anforderungen oder Einschränkungen zur IVDR stellt. Achtung! In der Schweiz, die in ihrer eigenen In-vitro Diagnostik Verordnung (IvDV, SR 812.219) auch in Bezug auf die In-house IVD im Wesentlichen auf die IVDR verweist, sind für alle Klassen A bis D die detaillierten Unterlagen nach Art. 5 (5)g, IVDR erforderlich (Artikel 9, IvDV).
 Dr. Sandra Reuter
Dr. Sandra Reuter
Was sind In-house IVD - und wann gelten IVD als solche?
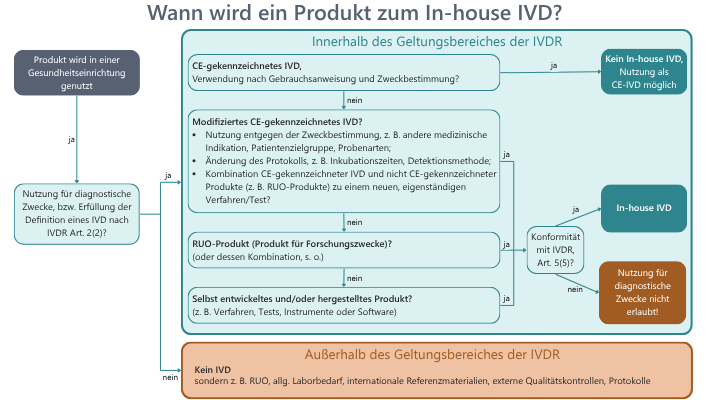
Viele medizinische Labore benutzen einerseits von IVD-Herstellern in Verkehr gebrachte, CE-markierte Produkte, andererseits aber auch In-house IVD, die hausintern hergestellt und nicht-CE-markiert sind, um Patientenproben zu untersuchen.Es herrscht teils noch viel Verwirrung, welche Produkte denn nun eigentlich als In-house IVD anzusehen sind und welche nicht. Unser kleiner Leitfaden hilft Ihnen, einen ersten Überblick zu bekommen.Als erstes stellt sich die Frage, ob das Produkt einen diagnostischen Zweck hat (bzw. für diagnostische Zwecke benutzt wird) und die Definition eines IVDs laut Art. 2 (2), IVDR erfüllt. Allgemeiner Laborbedarf, internationale Referenzmaterialien, externe Qualitätskontrollen und Protokolle fallen z.B. nicht unter diese Definition und damit auch nicht in den Geltungsbereich der IVDR.Auch Produkte für Forschungszwecke (research use only, RUO) sind per Definition kein IVD, sie sind eben nur für Forschungszwecke nutzbar. Aber Vorsicht, viele Labore nutzen RUO-Verfahren dennoch für diagnostische Zwecke: damit fallen sie in den Geltungsbereich der IVDR und dürfen nur verwendet werden, wenn das Labor für dieses Produkt die Konformität mit Art. 5 (5) der IVDR nachweisen kann. Auch für CE-gekennzeichnete IVD, die vom Labor entgegen ihrer Zweckbestimmung und Gebrauchsanweisung verwendet werden oder mit anderen Produkten neu kombiniert werden, muss die Konformität mit Art. 5 (5) nachgewiesen werden, damit sie vom Labor für diagnostische Zwecke verwendet werden dürfen. Auch eigens entwickelte und hergestellte Produkte können für die Diagnostik verwendet werden, - Sie ahnen es - wenn sie die Anforderungen an die In-house IVD erfüllen.
Welche IVDR-Anforderungen gelten ab wann?
Egal ob Sie als Laborbetreiber Ihr In-house IVD schon Jahre in Betrieb haben oder ob Sie gerade ein neues Produkt entwickeln oder kürzlich entwickelt haben: alle In-house IVD, die in Gesundheitseinrichtungen wie z. B. medizinischen Laboren der EU betrieben werden, müssen die Anforderungen der IVDR, Artikel 5 (5) erfüllen. In-house IVD-Hersteller unterliegen damit erstmalig EU-weit grundlegend einheitlichen Anforderungen in allen Mitgliedsstaaten.Anforderungen, die In-house Hersteller bereits seit dem 26.Mai 2022 erfüllen müssen:
- Erfüllung des Anhang I der IVDR: Grundlegende Sicherheits- und Leistungsanforderungen;
- Produkte dürfen nicht an andere rechtliche Einrichtungen abgegeben werden;
- Produkte dürfen nicht im industriellen Maßstab hergestellt werden.
Die Erfüllung des Anhang I ist zwar keine neue Anforderung für In-house IVD-Hersteller in Deutschland, denn dies war auch schon vor der IVDR durch das vorherige deutsche Gesetz über Medizinprodukte (Medizinproduktegesetz – MPG) gefordert. Allerdings ist dies eine der aufwändigsten Anforderungen an die Hersteller von In-house IVD: Um die Anforderungen des Anhang I zu erfüllen, müssen viele Nachweise und Dokumente erstellt werden, ähnlich derer für die Erstellung einer Technischen Dokumentation von CE-markierten IVD. Außerdem „verstecken“ sich im Anhang I u.a. die Forderung eines produktspezifischen Risikomanagements, der Betrachtung der Gebrauchstauglichkeit und der Durchführung einer Leistungsbewertung.Auch die beiden anderen Forderungen, dass In-house IVD nicht in Verkehr gebracht und nicht im industriellen Maßstab hergestellt werden dürfen, sowie die Forderung nach einem geeigneten Qualitätsmanagement-System (QMS - siehe nächster Absatz) sind nicht neu, sondern waren durch das MPG bereits gefordert.
Anforderungen, die In-house Hersteller seit dem 26. Mai 2024 erfüllen müssen:
Aufgrund der "Verordnung (EU) 2022/112 [...] vom 25. Januar 2022 zur Änderung der Verordnung (EU) 2017/746 hinsichtlich der Übergangsbestimmungen für bestimmte In-vitro-Diagnostika und des späteren Geltungsbeginns der Bedingungen für hausinterne Produkte" müssen folgenden Anforderungen erst seit dem 26. Mai 2024 von den In-house IVD-Herstellern erfüllt werden:- Einrichtung eines für die Herstellung und Verwendung (von In-house IVD) geeigneten QMS;
- Konformität mit EN ISO 15189 oder gegebenenfalls nationalen Vorschriften einschließlich nationaler Akkreditierungsvorschriften
- Auf Ersuchen der zuständigen Behörde (in Deutschland sind dies die Landesbehörden) Bereitstellung von Informationen über die Verwendung, inkl. Begründung für Herstellung, Änderung und Verwendung der In-house IVD;
- Verfassen einer öffentlich zugänglichen Erklärung zur Erfüllung des Anhang I;
- Detaillierte Unterlagen zu Herstellung, Design und Leistungsdaten von Klasse D-Produkten, so dass die zuständige Behörde die Erfüllung des Anhang I nachvollziehen kann;
- Sicherstellung, dass sämtliche Klasse D-Produkte im Einklang mit den oben genannten Unterlagen hergestellt werden;
- Produktbeobachtung: Begutachtung der Erfahrungen aus der klinischen Verwendung der Produkte, und Ergreifen der erforderlichen Korrekturmaßnahmen.
Anmerkung: Viele Labore arbeiten bereits nach EN ISO 15189, die allerdings keine Anforderungen an Entwicklung und Herstellung abdeckt. Für diese Aspekte empfiehlt sich eine Ergänzung durch relevante Kapitel der ISO 13485. Weitere Orientierung bieten die MDCG-Leitlinie 2023-1 zur Anwendung von Artikel 5(5) sowie – ergänzend – die neue ISO 5649:2024 zur Konzeption und Anwendung laborentwickelter Tests (LDTs). Auch wenn Letztere keine gesetzliche Verbindlichkeit besitzt, kann sie wertvolle Hinweise für die Praxis bieten.Wichtig für Klasse D-Produkte: Die Forderung einer in Bezug auf Herstellung, Design und Leistung detaillierten Dokumentation für Klasse D-Produkte hebt das Niveau der Technischen Dokumentation für In-house Hochrisiko-IVD noch weiter in Richtung CE-markierte IVD an.
Anforderungen, die In-house Hersteller ab dem 31. Dezember 2030 erfüllen müssen:
Aufgrund der ""Verordnung (EU) 2024/1860 […] vom 13. Juni 2024 zur Änderung der Verordnungen (EU) 2017/745 und (EU) 2017/746 hinsichtlich der schrittweisen Einführung von EUDAMED, der Informationspflicht im Falle einer Unterbrechung oder Beendigung der Versorgung und der Übergangsbestimmungen für bestimmte In-vitro-Diagnostika" muss folgende Anforderung des Artikel 5 (5), IVDR erst ab dem 31. Dezember 2030 von den In-house Herstellern erfüllt werden:- Begründung dafür, dass die spezifischen Erfordernisse der Patientenzielgruppe nicht bzw. nicht auf dem angezeigten Leistungsniveau durch ein gleichartiges auf dem Markt befindliches Produkt befriedigt werden können.
Die Erfüllung dieser Anforderung erfordert die Recherche der auf dem Markt befindlichen, gleichartigen CE-markierten Produkte.Für eine solche Recherche könnte u.a. die EUDAMED Datenbank genutzt werden. Als In-house IVD-Hersteller bzw. als Labor sollten Sie die Zeit, bis zur Deadline Ende 2030 sinnvoll nutzen, um geeignete Strategien für die Fortführung Ihrer In-house Produkte zu entwickeln, denn diese Anforderung stellt eine echte Herausforderung dar. Sie könnte dazu führen, dass die Labore viele ihrer hausinternen Produkte ab Dez 2030 nicht mehr verwenden können.Mögliche Szenarien:
- Es existiert kein gleichwertiges CE-markiertes Produkt zu Ihrem In-house IVD?
Dann dürfen Sie Ihr In-house IVD weiterhin verwenden. - Es existiert ein gleichwertiges CE-markiertes Produkt?
- Wenn Sie zeigen können, dass die Leistung Ihres In-house-Produkts besser ist, dürfen Sie es weiterhin verwenden.
- Wenn die Leistung Ihres In-house Produktes gleich oder schlechter ist als die des CE-IVD, dürfen Sie Ihr In-house Produkt ab 31. Dezember 2030 nicht mehr verwenden, es sei denn Sie verbessern und/oder erweitern die Leistung Ihres In-house IVDs im Vergleich zu den auf dem Markt befindlichen, vergleichbaren Produkten - dann dürfen Sie es auch nach dem 31. Dezember 2030 weiterverwenden. Alternativ werden Sie zum Hersteller und machen aus Ihrem In-house IVD ein CE-IVD.
Das bedeuten die IVDR-Anforderungen für medizinische Labore konkret
Zusammenfassend bedeuten die Anforderungen der IVDR an die Herstellung und Verwendung von In-house IVD:- einen höheren Dokumentationsaufwand für die Gesundheitseinrichtungen. Inwieweit die Mitgliedsstaaten die Forderung zur vollständigen, detaillierten Dokumentation auf Klasse A-, B- und C-Produkte ausweiten, bleibt abzuwarten.
- Die Transparenz der Herstellung und Verwendung von In-house-Tests wird erhöht.
- Behördliche Überwachungstätigkeiten werden erweitert.
- Hausinterne Tests dürfen ab dem 31.Dezember 2030 nicht mehr betrieben werden, sofern es ein hinsichtlich der Zweckbestimmung und Leistung gleichartiges Produkt auf dem Markt gibt.
Vor allem aufgrund des letzten Punktes besteht die Gefahr, dass viele In-house IVD in Zukunft nicht mehr hergestellt und verwendet werden dürfen. Zudem könnten viele Hersteller von In-house IVD den hohen Dokumentationsaufwand gerade für komplexe Produkte oder Produkte mit Risikoklasse D scheuen, mit der Konsequenz, dass diese dann nicht mehr hergestellt werden und verfügbar sind.Nationale Unterschiede
Die IVDR räumt den Mitgliedsstaaten das Recht ein, über die nationale Gesetzgebung noch weitere Anforderungen an In-house IVD stellen zu können, und auch die Herstellung und die Verwendung bestimmter Arten von In-house IVD können eingeschränkt werden. Die einzelnen EU-Mitgliedsstaaten können bspw. die Anforderung zur detaillierten Dokumentation auch auf die Produktklassen A, B und C erweitern (siehe auch MPDG §88 (1) 10.). Bisher ist z. B. in Deutschland aber noch keine entsprechende Verordnung verabschiedet worden, die zusätzliche Anforderungen oder Einschränkungen zur IVDR stellt. Achtung! In der Schweiz, die in ihrer eigenen In-vitro Diagnostik Verordnung (IvDV, SR 812.219) auch in Bezug auf die In-house IVD im Wesentlichen auf die IVDR verweist, sind für alle Klassen A bis D die detaillierten Unterlagen nach Art. 5 (5)g, IVDR erforderlich (Artikel 9, IvDV).
Was medizinische Labore jetzt tun sollten
- Erweiterung bzw. Anpassung Ihres QMS und Implementierung fehlender Prozesse
- Prüfung Ihrer produktspezifischen Dokumentation auf Vollständigkeit und Schließung der Lücken zur Erfüllung der Anforderungen aus Anhang I und Art.5(5), IVDR.
- Erstellung der geforderten Begründung, dass es für Ihr Produkt kein gleichartiges CE-markiertes Produkt gibt, so dass Sie dieses weiter betreiben dürfen: Führen Sie schnellstmöglich Produktrecherchen durch und analysieren Sie Ihr In-house IVD-Portfolio, um bestmöglich vorbereitet zu sein.
Fazit: Neue Anforderungen, neue Unsicherheiten – jetzt handeln
Die Anforderungen der IVDR bringen für Labore mit hausinternen Tests einen deutlichen Mehraufwand mit sich - sowohl in technischer als auch in strategischer Hinsicht. Besonders die Frist bis Ende 2030 verlangt eine frühzeitige Auseinandersetzung mit dem eigenen Produktportfolio. Ob Qualitätsmanagement, Technische Dokumentation oder Marktanalyse: Wer hier rechtzeitig die passenden Strukturen schafft, kann die regulatorischen Hürden meistern – und auch künftig auf bewährte In-house IVDs setzen.Sie möchten Ihre In-house-Produkte unter IVDR-Bedingungen sicher weiterverwenden oder sind unsicher, ob Ihr Labor bereits alle Anforderungen erfüllt? Es gibt viele Wege zur Konformität – wir unterstützen Sie gerne dabei, den passenden zu finden.Kontaktieren Sie uns jetzt für eine unverbindliche Erstberatung.
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.

Team Lead IVD
Regulatory Affairs & Technical Documentation


