Je nach Zielmarkt unterscheiden sich die regulatorischen Anforderungen für die Zulassung von In-vitro-Diagnostika (IVD). Es ist relevant, ob es um Märkte in Europa, Großbritannien, der Schweiz, den USA, China oder den MDSAP (Medical Device Single Audit Programm)-Ländern o. a. geht, denn: es gelten jeweils unterschiedliche Verordnungen und Gesetze. Die Unterschiede der Regularien sind teilweise groß und unterliegen immer wieder Änderungen, auf die es zu achten gilt. Hersteller von IVD müssen von der Produktentwicklung bis zur Markteinführung zahlreiche Anforderungen erfüllen. Steht von Anfang an fest, dass das Produkt auf mehreren Märkten In Verkehr gebracht werden soll, dann gilt es bereits zu Beginn die entsprechenden Regularien – wie die IVDR für die EU – zu beachten. Soll ein bestehender Markt erweitert werden, muss überprüft werden, welche zusätzlichen Anforderungen zu beachten sind.
Was sind die Aufgaben einer PRRC?
Die Aufgaben einer PRRC (Person Responsible for Regulatory Compliance) sind fest in der IVDR (Artikel 15) sowie der MDR definiert. Eine PRRC ist unter anderem verantwortlich für:
- Einhaltung der Regulierungsvorschriften
- Prüfung der Konformität der Produkte vor Produktfreigabe gemäß QMS
- Erstellung und ständige Aktualisierung der Technischen Dokumentation und EU-Konformitätserklärung
- Überwachung nach dem Inverkehrbringen (Erstellung eines Post-Market Surveillance-Systems)
- Erfüllung der Berichtspflichten (Vigilanz)
Voraussetzungen und Anforderungen an eine PRRC
In der EU ist nach Artikel 15 der IVDR für Hersteller von In-vitro-Diagnostika eine Verantwortliche Person für die Regulatorische Konformität (PRRC: Person Responsible for Regulatory Compliance) gefordert. Die Registrierung der verantwortlichen Person erfolgt in EUDAMED. Eine PRRC muss nicht nur Ihre Aufgaben gemäß IVDR, sondern auch einige Voraussetzungen erfüllen: Mindestens ein Jahr Berufserfahrung in Regulatory Affairs oder Qualitätsmanagement UND Studienabschluss in einem anerkannten Studienfach (z. B. Recht, Medizin, Pharmazie) ODER vier Jahre Berufserfahrung in Regulatory Affairs oder Qualitätsmanagement im Zusammenhang mit In-vitro-Diagnostika.
Ihre internationale Zulassungsstrategie optimal entwickeln
Internationale Zulassung ist komplex: Unser Regulatory Affairs-IVD-Team ist der Partner an Ihrer Seite, der die regulatorischen Anforderungen für die internationale Zulassung bestens kennt.Gemeinsam entwickeln wir mit Ihnen die optimale Zulassungsstrategie für Ihre Produkte und Ihren Zielmarkt/Ihre Zielmärkte. Wir unterstützen Sie maßgeblich dabei, dass Ihre Produkte korrekt klassifiziert und schnell in Ihren Zielmärkten zugelassen werden und übernehmen bei Bedarf gerne auch damit verbundene Aufgaben für Sie.Buchen Sie jetzt einen kostenlosen Termin zur gemeinsamen Planung Ihrer Strategie
Die internationale Zulassung von IVD-Produkten ist vielschichtig - eine strategische Vorgehensweise in Sachen Regulatory Affairs spart Zeit und Kosten.
Unsere Leistungen im Bereich Regulatory Affairs für IVD beinhalten:
Zulassungsstrategie
- Analyse (inter-)nationaler gesetzlicher Anforderungen sowie die Erarbeitung und Weiterentwicklung entsprechender Zulassungsstrategien,
- Betreuung der Zulassungsverfahren, Erstellung von Zulassungsanträgen für nationale und internationale Registrierungsverfahren, Planung und Erstellung der Änderungs- und Verlängerungsanträge,
- Aufbau und Pflege der Kontakte zu nationalen und internationalen Zulassungsbehörden, Zertifizierungsgesellschaften, Benannten Stellen sowie den nationalen und internationalen Gesundheitsbehörden,
- Unterstützung bei der Erstellung der Einreichungsunterlagen zur Zulassung von In-vitro-Diagnostika (IVD) in Europa (CE),
- Unterstützung bei der Erstellung der Einreichungsunterlagen (Registration Master File) zur Zulassung von In-vitro-Diagnostika (IVD) in verschiedenen Ländern wie USA (FDA), Australien (TGA), Kanada (CMDR), China (CFDA) oder Japan (PMDA) nach den jeweiligen gesetzlichen Vorgaben,
- Recherchen bestimmter regulatorischer Anforderungen für vorgegebene Zielländer sowie Beantwortung regulatorischer Fragestellungen (z. B. UDI, Klassifizierungen, Implementierung etc.)
Haben Sie schon einen Plan?
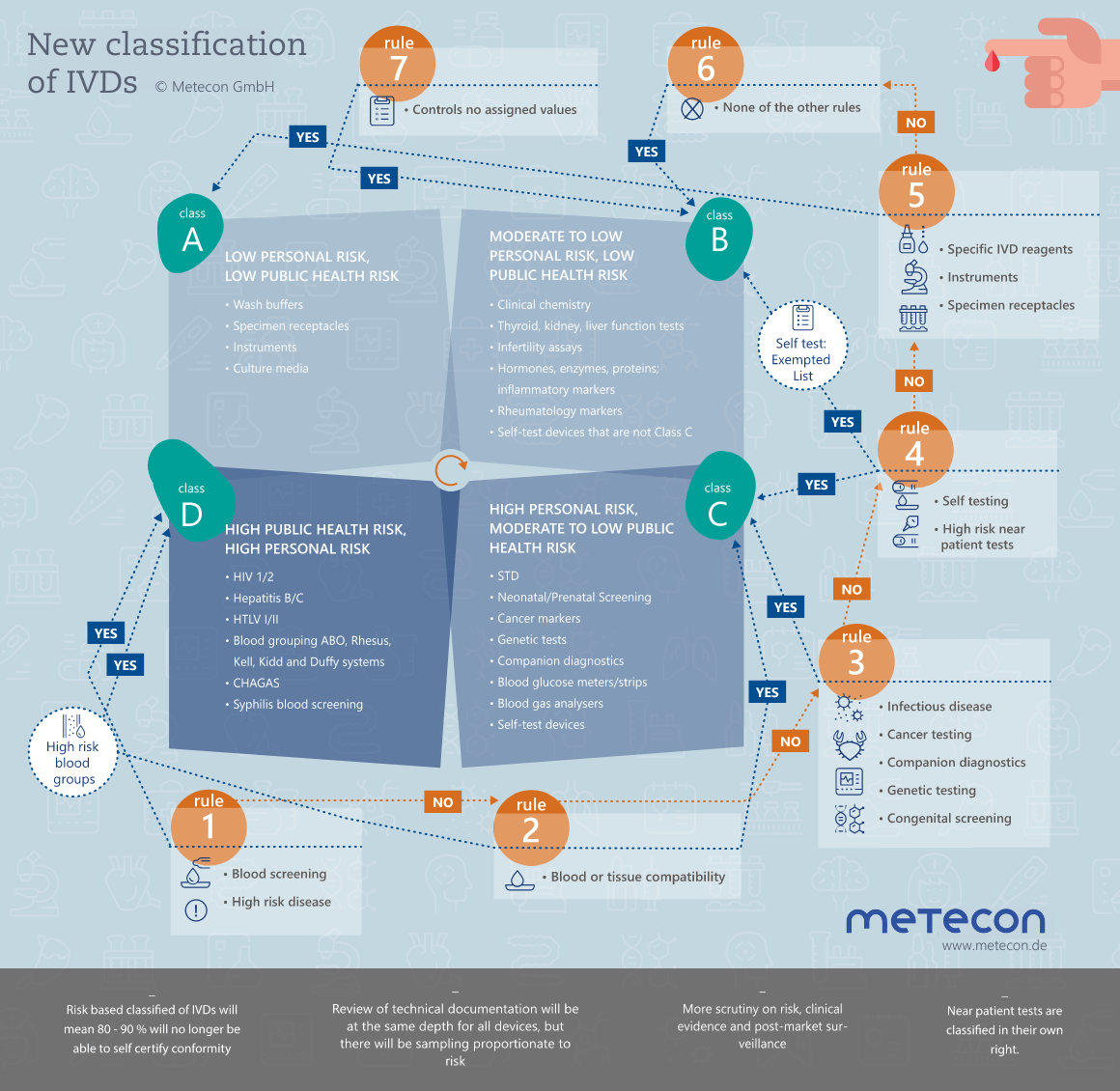
Die neuen Klassifizierungsregeln und die dadurch gesteigerte Regulierung über die Benannte Stelle konfrontieren Hersteller mit extremen Herausforderungen. Angesichts der zeitlichen Vorgaben muss die Überarbeitung der Technischen Dokumentation gut geplant und durchdacht sein. In einem ersten unverbindlichen Gespräch klären wir gerne Ihren Bedarf.
Vereinbaren Sie jetzt einen Termin und profitieren Sie von unserem Know-how!
Vereinbaren Sie jetzt einen Termin und profitieren Sie von unserem Know-how!
Wobei können wir Sie unterstützen?
Auch im Falle von Zertifizierung und Markteintritt gilt: andere Länder, andere Sitten. Profitieren Sie von unserer Expertise in Regulatory Affairs und bleiben Sie auf der sicheren Seite.Zulassung international
"A goal without a plan is just a wish" -
Lassen Sie uns gemeinsam so früh wie möglich die für Sie optimale Strategie entwickeln, um Ihren Erfolg länderübergreifend zu sichern.Zulassungsstrategie
Lassen Sie uns gemeinsam so früh wie möglich die für Sie optimale Strategie entwickeln, um Ihren Erfolg länderübergreifend zu sichern.Zulassungsstrategie