Post-Market-Surveillance-Daten in der Klinischen Bewertung - und die richtige Reihenfolge
13.02.2024
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
Das Aktualisieren von regulatorischen Dokumenten wie dem Klinischen Bewertungsbericht ist eine anstrengende, multidisziplinäre Aufgabe mit voneinander abhängigen Aktivitäten. Es ist eine verständliche Motivation, jeden Bericht zu aktualisieren, einschließlich der Verweise auf andere Berichte, die ebenfalls aktualisiert sein sollen. Häufig sind Vorlagen für Berichte so gestaltet, dass sie unüberlegt aufeinander verweisen, und die daraus resultierende Freigabe-Schleife kann nicht durch eine logische Reihenfolge gelöst werden.In diesem Blog versetzen wir den Leser in die Situation, den Abschnitt für Post-Market Surveillance (PMS) im Klinischen Bewertungsbericht (engl. Clinical Evaluation Report/CER) zu schreiben. Wir werden erklären, welche Inhalte zu berücksichtigen sind und welche anderen Berichte vor oder nach dem CER aktualisiert werden müssen.
Medical Device Regulation (EU) 2017/745 (MDR) , die einschlägigen MDCG-Dokumente (einschließlich MDCG 2020-13 Clinical Evaluation Assessment Report Template/CEAR) und die MEDDEV 2.7/1 findet man immer wieder die Anweisung, Daten aus PMS und Post-Market Clinical Follow-up (PMCF) in der Klinischen Bewertung zu verwenden, und andersherum klinische Ergebnisse in der PMS-Berichterstattung zu verwenden. Um das Verfassen des PMS-Abschnitts in der Klinischen Bewertung zu erleichtern, haben wir für Sie die geforderten Inhalte, deren erwähnten Fundort, und deren Bewegung zwischen den Berichten aus folgenden Regularien genau herausgelesen: MDR, MDCG 2020-6 (legacy devices), MDCG2020-7 (PMCF-Plan), MDCG2020-8 (PMCF-Bericht), MDCG 2020-13 (CEAR), sowie MEDDEV 2.7/1 (Klinische Bewertung) und 2.12/1 (Vigilanz).
Das ergibt keinen Widerspruch, wenn Sie die Wortwahl beachten: Es werden keine Berichte als Quelle genannt. Schreiben Sie also oder besser gesagt, beenden Sie Ihre Berichte in dieser Reihenfolge:
Damit wird die MDCG 2020-13 im Abschnitt A erfüllt: "Wenn der CER aktualisiert wurde, überprüfen Sie, ob diese Aktualisierung den jüngst aktualisierten PMS/PMCF-Berichten entspricht", ohne dass es zu Problemen beim Referenzieren von freigegebenen Dokumenten kommt.Beachten Sie bitte, alle nötigen Aktualisierungen in einem straffen Zeitrahmen durchzuführen, damit die Abstände zwischen dem Erlangen der Daten (z. B. Literatursuche) und den Berichten nicht zu lange werden (maximal 6 Monate alt).
d. h. bei einer anstehenden Aktualisierung wird zuerst der Plan der Klinischen Bewertung aktualisiert und darauffolgend der Klinische Bewertungsbericht. Das liegt daran, dass übliche Vorlagen vorsehen, den Plan der Klinischen Bewertung entsprechend den neuen Erkenntnissen in PMS zu aktualisieren.Aber lassen Sie uns überlegen, ob das tatsächlich (immer) so sein muss. Erinnern wir uns an die grundlegende Reihenfolge jeder Aktivität: Planen - Durchführen - Berichten. Wenn wir uns also in der Aktualisierungsphase befinden, sind wir am Ende der Durchführung angelangt! Daher sollten nun zunächst die Ergebnisse im Bericht zusammengefasst werden. Abweichungen vom Klinischen Bewertungsplan,
Wenn wir uns also in der Aktualisierungsphase befinden, sind wir am Ende der Durchführung angelangt! Daher sollten nun zunächst die Ergebnisse im Bericht zusammengefasst werden. Abweichungen vom Klinischen Bewertungsplan, z. B. bei Schlüsselbegriffen für die Literatursuche, können im Klinischen Bewertungsbericht offengelegt und dadurch erklärt werden, dass auf neue Informationen reagiert wurde. Und wenn Daten auf eine andere Art als geplant aufgekommen sind, werden sie im Bericht deswegen ja nicht ignoriert.Wenn alle Analysen und Schlussfolgerungen aus dem PSUR und CER vorliegen, dann kann der CEP darauf reagieren und gegebenenfalls aktualisiert werden – genau wie der PMCF-Plan aufbauend auf dem Klinischen Bewertungsbericht jetzt erst aktualisiert wird.Anschließend beginnt das Ganze von vorn mit der nächsten Durchführungsperiode der Aktivitäten gemäß der Planung.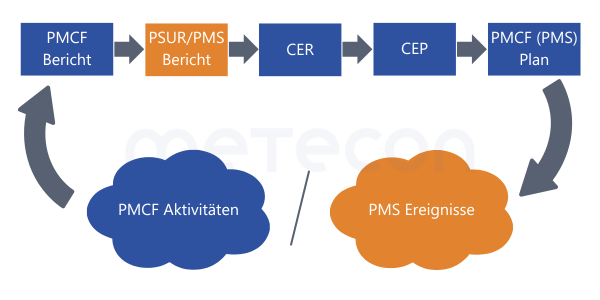 Wir wissen, dass es in der Praxis immer individuelle Lösungen braucht, um die Vorgaben der MDR möglichst effizient und passend zu angrenzenden Prozessen umzusetzen. Daher denken wir nicht nur über Alternativen bei der Reihenfolge der Aktivitäten nach, sondern auch über eine flexible Gestaltung der Dokumentation.Wenn z. B. getrennte Dokumente für CEP, Literatursuchplan, CDP (Klinischer Entwicklungsplan/Clinical Development Plan) und PMCF-Plan geführt werden, kann der CEP so gestaltet werden, dass er keine konkreten Aktivitäten beschreibt. Er stellt dann einen Top-Level-Plan dar und beschreibt, was evaluiert und dabei beachtet werden muss. Auf diese Weise kann der CEP ohne Kettenreaktion jederzeit aktualisiert werden, wann immer dies angebracht ist.
Wir wissen, dass es in der Praxis immer individuelle Lösungen braucht, um die Vorgaben der MDR möglichst effizient und passend zu angrenzenden Prozessen umzusetzen. Daher denken wir nicht nur über Alternativen bei der Reihenfolge der Aktivitäten nach, sondern auch über eine flexible Gestaltung der Dokumentation.Wenn z. B. getrennte Dokumente für CEP, Literatursuchplan, CDP (Klinischer Entwicklungsplan/Clinical Development Plan) und PMCF-Plan geführt werden, kann der CEP so gestaltet werden, dass er keine konkreten Aktivitäten beschreibt. Er stellt dann einen Top-Level-Plan dar und beschreibt, was evaluiert und dabei beachtet werden muss. Auf diese Weise kann der CEP ohne Kettenreaktion jederzeit aktualisiert werden, wann immer dies angebracht ist.
Was sind die formalen Anforderungen?
Bei einem Blick in dieGeforderter Inhalt
- MDR und MDCG erwarten klinische Daten aus dem PMS/PMCF, signifikante Beschwerden, Trends und Vigilanzfälle.
- MEDDEV erwartet neue klinische Daten, neue Erkenntnisse und Details zu allen Sicherheitskorrekturmaßnahmen im Feld, CE- und Marktstatus, seit wann, in welchen Regionen/Ländern und Verkaufsmengen.
Zu berücksichtigende Datenquellen
- MDR und MDCG nennen die Aktivitäten von PMS und PMCF sowie Berichte über Beschwerden und Zwischenfälle.
- MEDDEV nennt PMCF-Studien, PMS-Berichte, Vigilanz- und Trendberichte sowie Berichte über Zwischenfälle und Beschwerden an den Hersteller.
Welche Reihenfolge bietet sich für die Berichte an?
Es gibt zwei entscheidende Passagen in der MDR zu den Zusammenhängen zwischen PSUR, PMS, PMCF und CER:- Artikel 86(1) besagt, der PSUR enthält die Ergebnisse und Schlussfolgerungen nach PMS-Plan (und damit auch diejenigen nach PMCF-Plan, der ein Teil des PMS-Plans ist).
- Artikel 61(11) besagt, die Unterlagen der Klinischen Bewertung werden anhand der klinischen Daten nach PMCF-Plan und PMS-Plan aktualisiert.
Das ergibt keinen Widerspruch, wenn Sie die Wortwahl beachten: Es werden keine Berichte als Quelle genannt. Schreiben Sie also oder besser gesagt, beenden Sie Ihre Berichte in dieser Reihenfolge:
- PMCF-Bericht,
- PSUR (berücksichtigt jetzt die Schlussfolgerung aus dem PMCF-Bericht),
- CER (berücksichtigt daraufhin die klinisch relevanten Daten aus dem PMCF-Bericht sowie dem druckfrischen PSUR).
Damit wird die MDCG 2020-13 im Abschnitt A erfüllt: "Wenn der CER aktualisiert wurde, überprüfen Sie, ob diese Aktualisierung den jüngst aktualisierten PMS/PMCF-Berichten entspricht", ohne dass es zu Problemen beim Referenzieren von freigegebenen Dokumenten kommt.Beachten Sie bitte, alle nötigen Aktualisierungen in einem straffen Zeitrahmen durchzuführen, damit die Abstände zwischen dem Erlangen der Daten (z. B. Literatursuche) und den Berichten nicht zu lange werden (maximal 6 Monate alt).
Aktualisierung des Berichts vor dem Plan?
Klingt erst einmal erstaunlich, oder? In der Praxis wird üblicherweise andersherum vorgegangen, Wenn wir uns also in der Aktualisierungsphase befinden, sind wir am Ende der Durchführung angelangt! Daher sollten nun zunächst die Ergebnisse im Bericht zusammengefasst werden. Abweichungen vom Klinischen Bewertungsplan,
Wenn wir uns also in der Aktualisierungsphase befinden, sind wir am Ende der Durchführung angelangt! Daher sollten nun zunächst die Ergebnisse im Bericht zusammengefasst werden. Abweichungen vom Klinischen Bewertungsplan,  Wir wissen, dass es in der Praxis immer individuelle Lösungen braucht, um die Vorgaben der MDR möglichst effizient und passend zu angrenzenden Prozessen umzusetzen. Daher denken wir nicht nur über Alternativen bei der Reihenfolge der Aktivitäten nach, sondern auch über eine flexible Gestaltung der Dokumentation.Wenn z. B. getrennte Dokumente für CEP, Literatursuchplan, CDP (Klinischer Entwicklungsplan/Clinical Development Plan) und PMCF-Plan geführt werden, kann der CEP so gestaltet werden, dass er keine konkreten Aktivitäten beschreibt. Er stellt dann einen Top-Level-Plan dar und beschreibt, was evaluiert und dabei beachtet werden muss. Auf diese Weise kann der CEP ohne Kettenreaktion jederzeit aktualisiert werden, wann immer dies angebracht ist.
Wir wissen, dass es in der Praxis immer individuelle Lösungen braucht, um die Vorgaben der MDR möglichst effizient und passend zu angrenzenden Prozessen umzusetzen. Daher denken wir nicht nur über Alternativen bei der Reihenfolge der Aktivitäten nach, sondern auch über eine flexible Gestaltung der Dokumentation.Wenn z. B. getrennte Dokumente für CEP, Literatursuchplan, CDP (Klinischer Entwicklungsplan/Clinical Development Plan) und PMCF-Plan geführt werden, kann der CEP so gestaltet werden, dass er keine konkreten Aktivitäten beschreibt. Er stellt dann einen Top-Level-Plan dar und beschreibt, was evaluiert und dabei beachtet werden muss. Auf diese Weise kann der CEP ohne Kettenreaktion jederzeit aktualisiert werden, wann immer dies angebracht ist.Wie können wir helfen?
Benötigen Sie Unterstützung bei der Erstellung der klinischen Bewertung oder bei der Post-Market Surveillance? Oder befassen Sie sich gerade mit einem anderen komplexen Thema aus den Bereichen Clinical Affairs oder Technische Dokumentation und suchen daher nach erfahrenen Fachleuten? Melden Sie sich gerne jederzeit bei uns. Gemeinsam finden wir die beste Lösung für Ihr konkretes Anliegen.
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.



