Wie das MPEUAnpG das MPDG verändern wird
20.05.2022
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
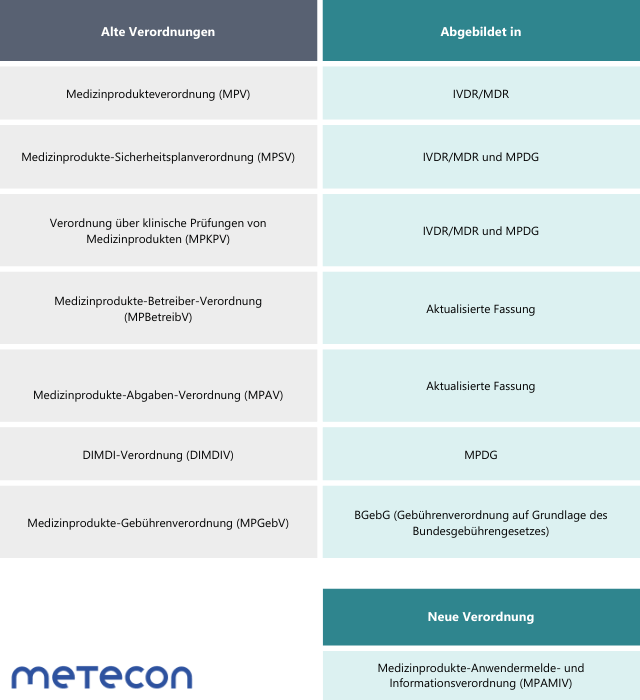
Vor kurzem hat Carsten Schüre die Unterschiede von MPG und MPDG dargestellt, jetzt zeigt er die Auswirkungen des MPEUAnpG auf das MPDG auf.Dieses Jahr ist es auch für Hersteller von In-vitro-Diagnostika soweit: Nachdem das Medizinprodukterecht-Durchführungsgesetz (MPDG) für Hersteller von Medizinprodukten bereits seit Mai 2021 anzuwenden ist, müssen dies ab dem 26. Mai auch die Hersteller von In-vitro-Diagnostika. Das MPDG ersetzt dabei das Medizinproduktegesetz (MPG), welches den Zweck hatte, die europäischen Richtlinien über Medizinprodukte (93/42/EWG), über aktive implantierbare medizinische Geräte (90/385/EWG) und über In-vitro-Diagnostika (98/79/EG) in nationales Recht umzusetzen. Damit einhergehend verlieren weitere Verordnungen ihre Gültigkeit, da diese bereits in der Verordnung (EU) 2017/745 (MDR) und der Verordnung (EU) 2017/746 (IVDR) oder im MPDG behandelt werden:Für größere Ansicht bitte Tabelle anklicken
Dabei übernimmt das DMIDS einige Funktionen, die eigentlich von der EUDAMED übernommen werden sollten. Da diese bislang noch nicht voll funktionsfähig ist, gelten im Rahmen der Übergangsvorschriften weiterhin die nationalen Systeme zur Erfassung von Produkten, Wirtschaftsakteuren, Zertifikaten oder zur Beantragung von klinischen Prüfungen (z. B. DMIDS (DE), MHRA (GB)). In diesem Zusammenhang wurde eine Bekanntmachung des Bundesministeriums für Gesundheit veröffentlicht, welche den Übergangszeitraum des MPDGs bis zur vollen Funktionsfähigkeit von EUDAMED regelt.
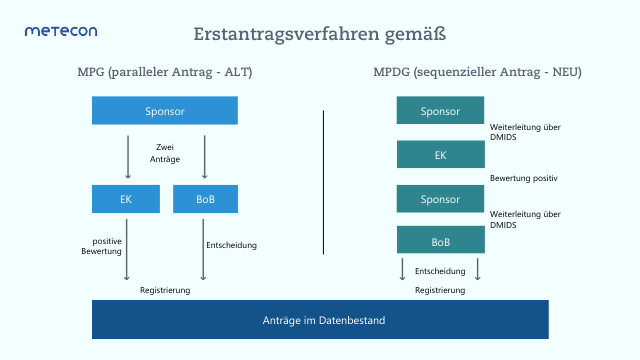
Abbildung 1: Erstantragsverfahren einer Leistungsprüfung nach MPG und MPDG
Die genauen Fristen und Abläufe einer Leistungsstudie sowie Leistungsstudien mit therapiebegleitenden Diagnostika werden nach der Aktualisierung durch das MPEUAnpG in § 31a und 31b beschrieben.
Diese Regelung gilt ebenfalls für Leistungsstudien, welche therapiebegleitende Diagnostika einbeziehen.Für größere Ansicht bitte Grafik anklicken
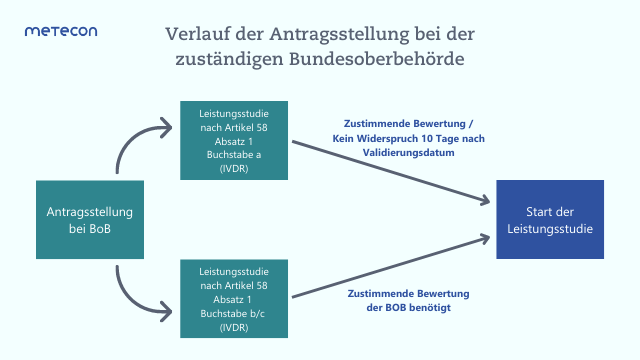
Abbildung 2: Verlauf der Antragsstellung bei der zuständigen Bundesoberbehörde
Des weiteren müssen Leistungsstudien mit therapiebegleitenden Diagnostika, bei denen nur Restproben verwendet werden, dem BfArM und dem Paul-Ehrlich-Institut über das DMIDS angezeigt werden. Hierbei müssen Kontaktdaten des Sponsors und des Herstellers des therapiebegleitenden Diagnostikums hinterlegt werden. Für den Fall, dass der Sponsor nicht in der Europäischen Union niedergelassen ist, müssen zusätzlich die Daten des rechtlichen Vertreters nach Artikel 58 Absatz 4 der IVDR angegeben sein. Dabei erhält das Paul-Ehrlich-Institut mit dem aktualisierten MPDG eine weitere Zuständigkeit, da es dann auch für die Genehmigung einer Leistungsstudie mit einem therapiebegleitenden Diagnostikum zuständig ist, welches für die sichere und wirksame Verwendung eines dazugehörigen Arzneimittels bestimmt ist, sofern das PEI, gemäß §77 Absatz 2 des Arzneimittelgesetzes für das Arzneimittel, zuständig ist.
 Björn-Carsten Schüre
Björn-Carsten Schüre

Relevante Änderungen durch das Medizinprodukte-EU-Anpassungsgesetz (MPEUAnpG)
Das MPDG ist in der Fassung 12. Mai 2021 nicht an In-vitro-Diagnostika gerichtet. Stattdessen wird in § 2 dargestellt, dass für In-vitro-Diagnostika bis einschließlich 25. Mai 2022 weiterhin das MPG in der aktuellsten Fassung sowie die Medizinprodukte-Verordnung (MPV) und die Verordnung über klinische Prüfungen von Medizinprodukten (MPKPV) gelten. Damit werden die In-vitro-Diagnostika frühzeitig aus dem Gesetz ausgeschlossen. Mit dem Medizinprodukte-EU-Anpassungsgesetz (MPEUAnpG) werden jetzt jedoch die In-vitro-Diagnostika in das MPDG integriert. Das MPEUAnpG ist in mehrere Artikel aufgeteilt und beinhaltet in Artikel 1 das komplette MPDG. Während sich Artikel 2 mit dem Wegfallen von § 87 des MPDGs befasst, werden in Artikel 3 die Änderungen beschrieben, welche im MPDG vorgenommen werden sollen, um die In-vitro-Diagnostika in das MPDG einzubauen. So wird z. B. "klinische Prüfung" künftig um "oder Leistungsstudie" ergänzt. Zudem werden nach Verweisen auf die MDR auch die passenden Verweise zur IVDR eingefügt. Weitere Anpassungen durch das MPEUAnpG werden in Artikel 3a – 16a beschrieben. Dabei handelt es sich um Anpassungen weiterer Rechtsnormen wie bspw. dem Atomgesetz, Strahlenschutzgesetz und Arzneimittelgesetz. Diese Änderungen betreffen u. a. ebenfalls Verweise auf die MDR/IVDR sowie Definitionsänderungen in den jeweiligen Rechtsnormen.In Artikel 17 werden zum Schluss das Inkraft- und Außerkrafttreten des MPEUAnpG und weiterer Verordnungen geregelt. So wird an dieser Stelle darauf verwiesen, dass das MPEUAnpG vorbehaltlich der Absätze 2 – 8 am 26. Mai 2021 und von Artikel 3 die Nummern 1, 3 – 42 sowie 44 – 68 am 26. Mai 2022 in Kraft treten. Gleichzeitig sind mit dem 26. Mai 2021 bereits die Paragrafen 1 – 32a sowie 34 – 44 des MPGs außer Kraft getreten. Es ist bereits vorgemerkt, dass spätestens ab dem 26. Mai 2022 eine aktualisierte Fassung des MPDGs veröffentlicht wird, welche die Änderungen nach Artikel 3 des MPEUAnpG enthalten wird. Des Weiteren werden auch die Änderungen nach Artikel 2 des "Gesetz zur Änderung des Medizinprodukterecht-Durchführungsgesetzes und weiterer Gesetze" eingefügt, um eine erleichterte Lesbarkeit zu garantieren.Die vielfältigen Aufgaben des DMIDS
Beim DMIDS (Deutsches Medizinprodukte-Informations- und Datenbanksystem) handelt es sich um den Nachfolger des DIMDI. Seine volle Funktionsfähigkeit soll nach § 86 des MPDGs bis spätestens 31. Dezember 2022 gegeben sein. § 86 des MPDGs befasst sich mit dem DMIDS, welches nach Artikel 33 der MDR bzw. Artikel 30 der IVDR für den Austausch von Informationen und Daten zwischen dem DMIDS und der Europäischen Datenbank für Medizinprodukte dient. Des Weiteren dient es:- als zentrales Portal für nach dem MPDG zu stellende Anträge,
- zu Eingabe und Abruf von Daten und Informationen durch die zuständigen Behörden des Bundes und der Länder und
- zur Bereitstellung von Daten aus der Europäischen Datenbank für Medizinprodukte für die zuständigen Behörden des Bundes und der Länder.
Dabei übernimmt das DMIDS einige Funktionen, die eigentlich von der EUDAMED übernommen werden sollten. Da diese bislang noch nicht voll funktionsfähig ist, gelten im Rahmen der Übergangsvorschriften weiterhin die nationalen Systeme zur Erfassung von Produkten, Wirtschaftsakteuren, Zertifikaten oder zur Beantragung von klinischen Prüfungen (z. B. DMIDS (DE), MHRA (GB)). In diesem Zusammenhang wurde eine Bekanntmachung des Bundesministeriums für Gesundheit veröffentlicht, welche den Übergangszeitraum des MPDGs bis zur vollen Funktionsfähigkeit von EUDAMED regelt.
Die größte Herausforderung des MPDGs: Die Anmeldung einer Leistungsstudie
Mit dem Inkrafttreten des MPDGs für In-vitro-Diagnostika kommen einige Änderungen auf Sie als IVD-Hersteller zu. Die größte Änderung betrifft dabei die Anmeldung einer Leistungsstudie: Unter dem MPG war es noch möglich, eine Leistungsstudie zeitgleich sowohl bei der zuständigen Ethikkommission (EK) als auch bei der zuständigen Bundesoberbehörde (BoB) anzumelden. Das ändert sich mit Inkrafttreten des MPDGs: Ab sofort gilt ein sequentielles Verfahren, wonach die Anmeldung einer Leistungsstudie bei der BoB erst nach einem zustimmenden Votum der EK erfolgen darf (vgl. Abbildung 1). Für größere Ansicht bitte Grafik anklicken
Abbildung 1: Erstantragsverfahren einer Leistungsprüfung nach MPG und MPDG
Die genauen Fristen und Abläufe einer Leistungsstudie sowie Leistungsstudien mit therapiebegleitenden Diagnostika werden nach der Aktualisierung durch das MPEUAnpG in § 31a und 31b beschrieben.
- So darf mit Leistungsstudien, welche nach Artikel 58 Absatz 1 Buchstabe a der IVDR durchgeführt werden und bei denen die Probennahme kein erhebliches klinisches Risiko für die Prüfungsteilnehmer*innen darstellen, erst begonnen werden, wenn die BoB innerhalb von 10 Tagen nach Validierungsdatum nicht widersprochen hat.
- Leistungsstudien, die nach Artikel 58 Absatz 1 Buchstabe b oder c der IVDR durchgeführt werden, brauchen hingegen eine zustimmende Bewertung der BoB. Die BoB prüft in diesem Fall, ob ein erhebliches klinisches Risiko für die Prüfungsteilnehmer*innen durch die Probenentnahme besteht. Ist dies der Fall, widerspricht die BoB dem Beginn einer Leistungsstudie (vgl. Abbildung 2).
Diese Regelung gilt ebenfalls für Leistungsstudien, welche therapiebegleitende Diagnostika einbeziehen.Für größere Ansicht bitte Grafik anklicken

Abbildung 2: Verlauf der Antragsstellung bei der zuständigen Bundesoberbehörde
Des weiteren müssen Leistungsstudien mit therapiebegleitenden Diagnostika, bei denen nur Restproben verwendet werden, dem BfArM und dem Paul-Ehrlich-Institut über das DMIDS angezeigt werden. Hierbei müssen Kontaktdaten des Sponsors und des Herstellers des therapiebegleitenden Diagnostikums hinterlegt werden. Für den Fall, dass der Sponsor nicht in der Europäischen Union niedergelassen ist, müssen zusätzlich die Daten des rechtlichen Vertreters nach Artikel 58 Absatz 4 der IVDR angegeben sein. Dabei erhält das Paul-Ehrlich-Institut mit dem aktualisierten MPDG eine weitere Zuständigkeit, da es dann auch für die Genehmigung einer Leistungsstudie mit einem therapiebegleitenden Diagnostikum zuständig ist, welches für die sichere und wirksame Verwendung eines dazugehörigen Arzneimittels bestimmt ist, sofern das PEI, gemäß §77 Absatz 2 des Arzneimittelgesetzes für das Arzneimittel, zuständig ist.
Fazit
Das MPG wird Geschichte. Am 26. Mai 2022 tritt das MPDG auch für die In-vitro-Diagnostika in Kraft und löst damit das MPG ab. Um die In-vitro-Diagnostika in das MPDG zu integrieren, wurde u. a. das Medizinprodukte-EU-Anpassungsgesetz (MPEUAnpG) aufgesetzt. Das MPEUAnpG aktualisiert das MPDG und zeigt in Artikel 3 auf, wie diese Integration vonstatten geht. Dabei werden ergänzende Begriffe und Verweise auf die IVDR eingefügt, aber es wird hinsichtlich des Anmeldeverfahrens der unterschiedlichen Leistungsstudien bei der zuständigen BoB auch schwerwiegende Veränderungen geben. Eine weitere wichtige Neuerung betrifft die generelle Anmeldung einer Leistungsstudie bei der zuständigen Ethikkommission und der zuständigen BoB. Im Gegensatz zum MPG ist es nicht mehr möglich, Anträge parallel bei der EK und der BoB einzureichen. Stattdessen verlangt die zuständige BoB bei Antragsstellung bereits eine zustimmende Bewertung der EK. Spätestens zum 26. Mai 2022 wird es eine aktualisierte Fassung des MPDGs geben, welche die Änderungen aus dem MPEUAnpG sowie nach Artikel 2 des "Gesetz zur Änderung des Medizinprodukterecht-Durchführungsgesetzes und weiterer Gesetze" enthalten wird.Falls Sie Fragen zur Umsetzung des MPDGs oder allgemein zu Ihren In-vitro-Diagnostika oder sonstigen Medizinprodukten haben, helfen wir Ihnen gerne weiter! Sollte es weitere Neuigkeiten zum MPDG geben, hören Sie natürlich wieder von uns.Bis dahin wünsche ich Ihnen ein gesundes und erfolgreiches Compliance-Jahr.Beste Grüße
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.

Regulatory Affairs & Technical Documentation


