IVD unterliegen der In Vitro Diagnostic Medical Devices Regulation (IVDR), die besonders strenge Anforderungen an Sicherheit, Leistung und Nachweise stellt. Damit Ihr Produkt den Marktzugang erhält, müssen Klassifizierung nach IVDR, Qualitätsmanagement und Technische Dokumentation nahtlos zusammenspielen.Was gehört zur erfolgreichen IVD-Compliance?
- Präzise Definition und Klassifizierung nach IVDR
- Qualitätsmanagementprozesse für sichere und zuverlässige Produkte
- Nachweis von Sicherheit und Leistung über den gesamten Lebenszyklus
- vollständige Technische Dokumentation als Beleg für die Konformität
- Berücksichtigung spezifischer Anforderungen je Zielland
Neue Übergangsfristen
Mit der Verordnung (EU) 2024/1860 vom 13. Juni 2024 gibt die EU-Kommission Herstellern unter bestimmten Bedingungen mehr Zeit für den Übergang zur Verordnung (EU) 2017/746 (IVDR). Behalten Sie den Überblick über alle Änderungen.Benötigen Sie dabei Unterstützung? Wir freuen uns darauf, zu Ihrem Teamerfolg beizutragen.
Unsere Leistungen für Ihr IVD
Erstellung und Pflege der Technischen Dokumentation:
Lassen Sie uns gemeinsam herausfinden, wo unsere Unterstützung sinnvoll sein kann.
- Prüfung der Technischen Dokumentation von In-vitro-Diagnostika, die bereits auf dem Markt sind ("Legacy Devices", "Old Devices"), auf Konformität mit den regulatorischen Anforderungen,
- Erstellung der Inhalte der Technischen Dokumentation (EU und international) – in Übereinstimmung mit Normen, Gesetzen und Regularien für bestehende Produkte sowie im Rahmen von Neuentwicklungen,
- Integration von Risikomanagement und Usability-Aspekten,
- Kommunikation mit Benannten Stellen, Behörden und Prüflaboren für analytische und/oder klinische Studien,
- Überprüfung und Anpassung der Umsetzung der IVDR-Anforderungen basierend auf neuen MDCG-Guidelines,
- Verifizierung und Validierung von Prozessen und Produkten.
- Strategische Beratung und operative Unterstützung in allen regulatorischen Fragestellungen,
- Planung und Durchführung von Post-Market-Surveillance (PMS)-Aktivitäten,
- Erstellung von Berichten und Begleitung bei Vigilanzprozessen.
- Planung und Durchführung der Leistungsbewertung; Planung und Begleitung von Leistungsstudien; Strategie für Ihre PMPF-Prozesse, Unterstützung und Begleitung aller PMPF-Aktivitäten,
- Unterstützung im Genehmigungsprozess Ihrer klinischen Studien, z. B. Anträge an die Ethikkommission und die zuständige Bundesoberbehörde (BOB),
- Koordination / Kommunikation mit Studienzentren, Laboren und Behörden.
- Analyse des Änderungsbedarfs,
- Anpassung von Prozessen,
- Begleitung bei Audits.
- Digitalisierung regulatorischer Prozesse: Beratung, Implementierung & Unterstützung
- Softwareentwicklungsprozesse gemäß IEC 62304,
- Performance Evaluation für Softwareprodukte,
- Unterstützung bei Dokumentation und QMS,
- Integration von Cybersecurity-Anforderungen und KI-spezifischen Compliance-Aspekten.
- Übernahme der Rolle als EC-REP oder CH-REP für Hersteller ohne Sitz in der EU oder der Schweiz,
- Sicherstellung der regulatorischen Kommunikation mit Behörden und Marktüberwachung,
- zuverlässige und partnerschaftliche Vertretung auf dem europäischen und schweizerischen Markt.
- Unterstützung bei der Suche nach geeigneten Laboren oder Anbietern von Humanproben wie Seren oder Plasma,
- Koordination externer Partner für analytische und klinische Datenerhebung.
Lassen Sie uns gemeinsam herausfinden, wo unsere Unterstützung sinnvoll sein kann.
Ihre Ansprechpartner bei allen Fragen rund um die Regulatory Compliance Ihres IVD


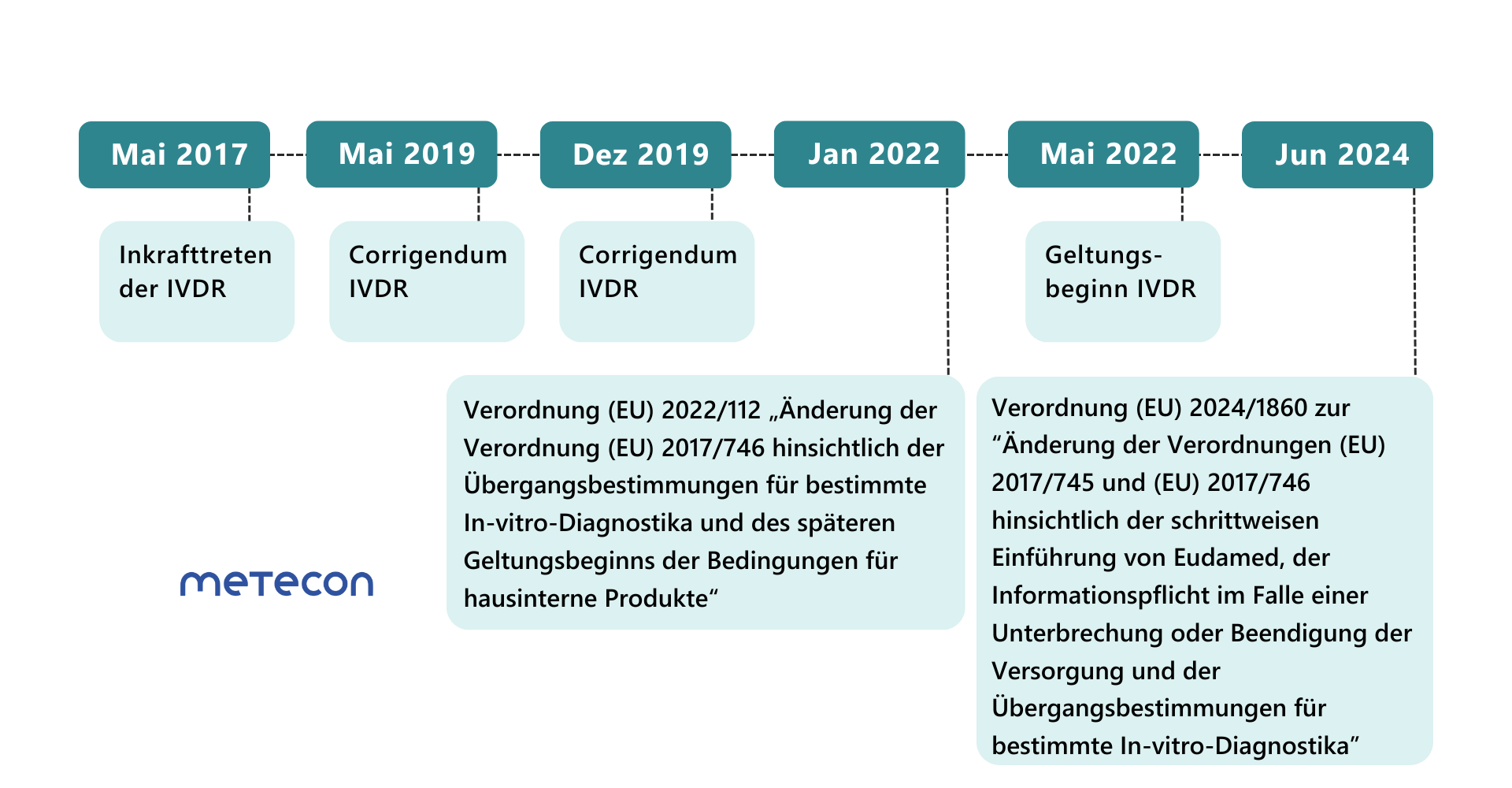
Änderungsverordnung (EU) 2022/112: Erste Verlängerung der Übergangsfristen für IVD
Anfang 2022 wurden die Übergangsfristen für die meisten Produktklassen verlängert. Der Geltungsbeginn der IVDR wurde jedoch nicht verschoben. Seit dem 26.05.2022 müssen bereits einige Anforderungen der IVDR für alle Produktklassen erfüllt werden, hierzu zählen die- Überwachung nach dem Inverkehrbringen,
- Marktüberwachung (durch die entsprechenden Behörden),
- Vigilanz und
- Registrierung von Wirtschaftsakteuren und von Produkten.
Fragen hierzu? Wir beantworten sie gern!
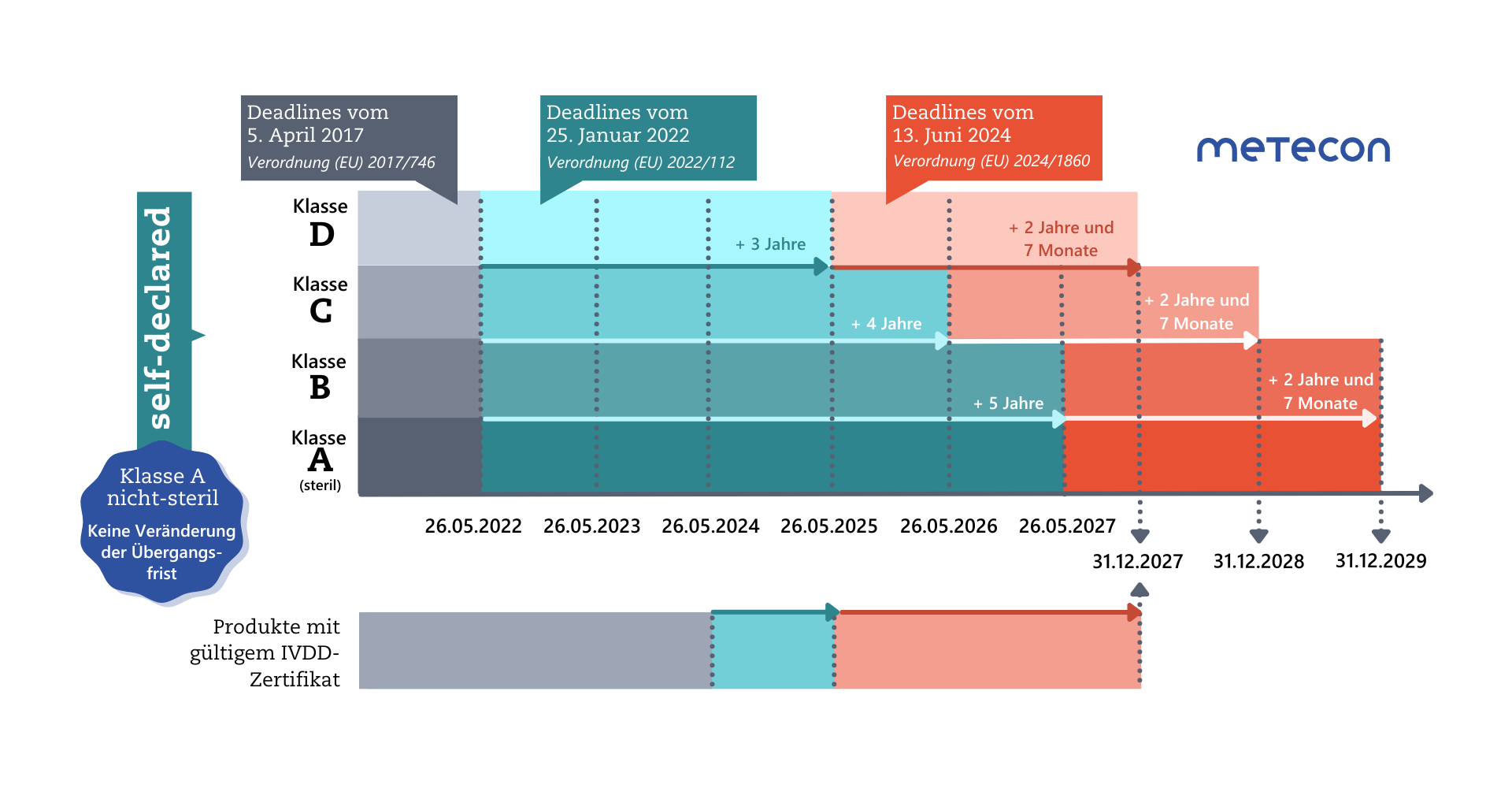
Änderungsverordnung (EU) 2024/1860: Erneute Verlängerung der Übergangsfristen für IVD
Weniger als ein Jahr vor Ablauf der verlängerten Übergangsfristen für Klasse-D-Produkte am 26.5.2025 hat die EU-Kommission eine weitere Verordnung zur erneuten Verlängerung der Übergangsfristen von IVD veröffentlicht.Diese Übergangsfristen können nur dann Anwendung finden, wenn die Hersteller bestimmte Bedingungen erfüllen:
Die Bedingungen aus der ersten Verordnung zur Verlängerung der Übergangsfristen ((EU) 2022/112) bleiben erhalten: Die Produkte müssen weiterhin der IVDD entsprechen und es darf keine wesentlichen Änderungen an ihrer Auslegung und Zweckbestimmung geben.Als neue Bedingungen kommen hinzu:
- Die Produkte stellen kein unannehmbares Risiko für die Gesundheit oder Sicherheit von Patienten, Anwendern oder anderen Personen oder für andere Aspekte des Schutzes der öffentlichen Gesundheit dar. Hinweis: dies liegt im Verantwortungs- und Aufgabenbereich der zuständigen Behörden (Artikel 89 und 90 der IVDR) und stellt keine zusätzliche Anforderung für die Hersteller dar.
- Der Hersteller hat bis spätestens 26. Mai 2025 ein Qualitätsmanagementsystem (QMS) gemäß Artikel 10 Absatz 8 eingerichtet.
- Für die Legacy Devices muss bis zu einem bestimmten Datum ein Antrag für das Konformitätsbewertungsverfahren nach IVDR vom Hersteller bei einer Benannten Stelle gestellt werden: bis 26. Mai 2025 (Klasse D), 26 Mai 2026 (Klasse C), 26 Mai 2027 (Klasse B und sterile Produkte der Klasse A).
- Innerhalb von weiteren 4 Monaten der jeweiligen Frist muss eine schriftliche Vereinbarung mit der Benannten Stelle vorliegen.
Möchten Sie sich Klarheit für Ihre Produkte verschaffen? Wir stehen jederzeit für ein Gespräch zur Verfügung.
Wie werden bestehende Zertifikate gemäß IVDR verlängert?
Bestehende Zertifikate werden gemäß Artikel 110 Absatz 2 der IVDR (in der Fassung vom 9. Juli 2024) nun wie folgt verlängert:"Bescheinigungen, die von Benannten Stellen gemäß der Richtlinie 98/79/EG nach dem 25. Mai 2017 ausgestellt wurden, am 26. Mai 2022 noch gültig waren und danach nicht zurückgezogen wurden, bleiben nach Ablauf des auf der Bescheinigung angegebenen Zeitraums bis zum 31. Dezember 2027 gültig.Bescheinigungen, die von Benannten Stellen gemäß der genannten Richtlinie nach dem 25. Mai 2017 ausgestellt wurden, am 26. Mai 2022 noch gültig waren und vor dem 9. Juli 2024 abgelaufen sind, gelten nur dann als bis zum 31. Dezember 2027 gültig, wenn eine der folgenden Bedingungen erfüllt ist:a) Vor Ablauf der Bescheinigung haben der Hersteller und eine Benannte Stelle eine schriftliche Vereinbarung gemäß Anhang VII Abschnitt 4.3 Unterabsatz 2 über die Konformitätsbewertung des Produkts, für das die abgelaufene Bescheinigung gilt, oder eines Produkts, das dazu bestimmt ist, dieses Produkt zu ersetzen, unterzeichnet;b) eine zuständige Behörde eines Mitgliedstaats hat eine Ausnahme von dem anwendbaren Konformitätsbewertungsverfahren gemäß Artikel 54 Absatz 1 gewährt oder den Hersteller gemäß Artikel 92 Absatz 1 aufgefordert, das anzuwendende Konformitätsbewertungsverfahren durchzuführen."
Technische Dokumentation für In-vitro-Diagnostika
Die Technische Dokumentation muss im Rahmen der IVDR für alle bestehenden Produkte im gesamten Kontext überarbeitet und angepasst werden. Die Ergebnisse des Risikomanagements beeinflussen die Leistungsbewertung und Gebrauchstauglichkeit/Usability Ihres IVD und umgekehrt. Zweck, Anforderungen, Spezifikationen, Verifizierung/Validierung und Kennzeichnung müssen aufeinander abgestimmt sein. Daher ist eine Rückverfolgbarkeit von der Produktidee bis zum fertigen Produkt erforderlich.Anforderungen an die Post Market Surveillance (PMS) müssen ebenfalls umgesetzt werden. Je nach Risikoklasse sind unterschiedliche Berichte erforderlich, PMS-Berichte für Klasse A & B oder der Periodic Safety Update Report (PSUR) für Klasse C & D. Nicht zu vergessen: auch der zusammenfassende Bericht über Sicherheit und Leistung ( Summary of Safety and Performance, SSP) für Produkte der Klassen C & D ist erforderlich.Informationen zum Inhalt der geforderten Berichte, denen immer ein Plan vorausgeht, finden sich in der IVDR und in spezifischen Leitlinien der MDCG (Medical Device Coordination Group).
Wie viel Zeit kostet die IVDR-Anpassung? Ein realistisches Rechenbeispiel
Aus unseren Gesprächen mit Herstellern wissen wir, dass gerne mit je 200 Arbeitsstunden für die Überarbeitung einer Produktakte gerechnet wird. So weit, so gut: Das macht ca. 5 Wochen reine Arbeitszeit für eine Vollzeitkraft. Warum "reine" Arbeitszeit? Weil diese Rechnung folgendes voraussetzt:- Die Vollzeitkraft wurde geschult;
- ein Projektplan zum genauen Vorgehen existiert;
- die Vollzeitkraft weiß exakt, wie die Anforderungen umzusetzen sind;
- es fallen in diesen 5 Wochen keine weiteren Tätigkeiten für Ihre Regulatory Affairs-Mitarbeiter*in an;
- die Zusammenarbeit zwischen den Abteilungen erfolgt reibungslos und ohne Zwischenfälle.
Ist dieses Szenario tatsächlich realistisch? Erfahrungsgemäß funktioniert es in den seltensten Fällen wie oben beschrieben. Bei Ihrer Planung sollten Sie zusätzlich berücksichtigen, dass Ihre Prozesse seitens des Qualitätsmanagements ebenfalls überarbeitet und neue Templates erstellt werden müssen.
Unterstützung gewünscht? Wir freuen uns darauf, zu Ihrem Teamerfolg beizutragen.
Ihre Vorteile aus der Zusammenarbeit mit uns
- Wir sind Ihr verlässlicher Partner bei der Anpassung Ihrer QM-Prozesse und der Erstellung und Überarbeitung der Technischen Dokumentation Ihrer IVD.
- Sie erhalten alle Dokumente für Ihre Technische Dokumentation unterschriftsreif auf Ihren Vorlagen für die Zulassung (international) bzw. Produktzertifizierung (EU). Gerne stellen wir Ihnen auch Vorlagen zur Verfügung und beraten Sie bei der Wahl des geeigneten Formats für Ihre Technische Dokumentation (IMDRF, STED).
- Unsere Erfahrung sowohl in der Dokumentation, dem Zertifizierungsprozess und auch in der Verifikation und Validierung von IVD sorgen dafür, dass wir Ihre Ziele schnell und effizient erreichen.
- Unsere GAP-Analysen liefern Handlungsempfehlungen auf allen Ebenen Ihrer regulatorischen Aktivitäten (QM-System, Technische Dokumentation, Produktportfolio).