Test-Traceability: Das steckt hinter der Anforderungsrückverfolgbarkeit
14.03.2023
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
Die Anforderungsrückverfolgbarkeit (Test-Traceability) ist ein wichtiger Teil des Qualitätsmanagements von Medizinprodukten. Ihr Ziel ist es, die Anforderungen der Stakeholder an das Produkt zu identifizieren, zu verfolgen und schließlich sicherzustellen, dass sie erfüllt werden. Welcher regulatorische Rahmen gilt für die Test-Traceability? Wie lässt sie sich erfolgreich in der Praxis umsetzen? Was ist eine Traceability-Matrix? Wir haben die relevanten Vorgaben zusammengefasst und daraus praktisch anwendbare Empfehlungen für Sie abgeleitet.Die Traceability (Rückverfolgbarkeit) beschreibt das Vorgehen, die Beziehungen zwischen Artefakten des Entwicklungsprozesses nachzuvollziehen. Eine Definition der "Traceability" gibt die ISO/IEC/IEEE 24765:2017 für den Bereich des System- und Software-Engineerings: "Unterscheidbare Verknüpfung zwischen zwei oder mehr logischen Entitäten wie Anforderungen, Systemelementen, Überprüfungen und Aufgaben".Für die Hersteller von Medizinprodukten ist insbesondere die Test-Traceability relevant. Deren Umsetzung kann in der Praxis eine Reihe von Fragen aufwerfen, die wir mit diesem Beitrag beantworten möchten.
Es ist wichtig, die Test-Traceability regelmäßig zu überprüfen und zu aktualisieren. Damit wird sichergestellt, dass die Patientensicherheit gewährleistet bleibt und regulatorische Anforderungen erfüllt werden.
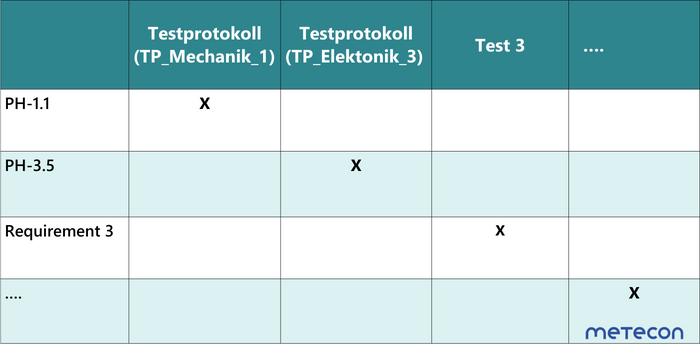
 Eine weitere Möglichkeit sind Matrices, in der "nur" die Anforderungen und Test-ID dargestellt werden (Tabelle 2). Hiermit lässt sich leicht prüfen, ob jede Anforderung mit einem Test verifiziert wurde. Allerdings enthält sie keine Informationen, woher die Anforderung kommt.Tabelle 2 Traceability-Matrix mit Anforderung und Testfall
Eine weitere Möglichkeit sind Matrices, in der "nur" die Anforderungen und Test-ID dargestellt werden (Tabelle 2). Hiermit lässt sich leicht prüfen, ob jede Anforderung mit einem Test verifiziert wurde. Allerdings enthält sie keine Informationen, woher die Anforderung kommt.Tabelle 2 Traceability-Matrix mit Anforderung und Testfall
 Bei RTM mit größeren Datensätzen können Word- oder Excel-Dokumente sehr aufwändig und unübersichtlich werden. In diesen Fällen bieten sich verschiedene Software-Lösungen an.
Bei RTM mit größeren Datensätzen können Word- oder Excel-Dokumente sehr aufwändig und unübersichtlich werden. In diesen Fällen bieten sich verschiedene Software-Lösungen an.
Herzliche Grüße
Warum müssen Hersteller die Test-Traceability umsetzen?
Die Test-Traceability wird in verschiedenen Richtlinien und Normen beschrieben und explizit eingefordert.- Als wichtiger Bestandteil der ISO 13485 wird die Test-Traceability in den folgenden Abschnitten behandelt:
- Im Kapitel 7.3.2 "Entwicklungsplanung" wird unter Punkt e) gefordert, dass die Organisation die Verfahren zur Sicherstellung der Rückverfolgbarkeit der Entwicklungsergebnisse bezüglich der Entwicklungseingaben dokumentieren muss.
- Kapitel 7.3.4 "Entwicklungsergebniss" verlangt, dass die Entwicklungsergebnisse gegen die Entwicklungseingaben verifizierbar sind und vor der Freigabe genehmigt werden müssen.
- Die Norm DIN EN 60601-1 der Internationalen Elektrotechnischen Kommission (IEC) für medizinische elektrische Geräte sieht ebenfalls eine Rückverfolgbarkeit zwischen Tests und Anforderungen vor. Diese Norm spezifiziert die Anforderungen an die Sicherheit medizinischer elektrischer Geräte und Systeme, einschließlich der Rückverfolgbarkeit zwischen den Prüfergebnissen und den Anforderungen, die der Entwicklung und Konstruktion des Geräts zugrunde lagen.
- Schließlich besteht die MDR (Verordnung (EU) 2017/745) in Kapitel II Absatz 10 ihrer "Grundlegenden Sicherheits- und Leistungsanforderungen" indirekt auf die Traceability: "Bestätigung, dass das Produkt alle festgelegten chemischen und/oder physikalischen Spezifikationen erfüllt."
Welche Vorteile bietet die Test-Traceability?
Die Vorteile der Test Traceability liegen auf der Hand:- Einer der wichtigsten Vorteile ist ihr Beitrag, um die Sicherheit und Wirksamkeit von Medizinprodukten zu gewährleisten. Dank der Nachvollziehbarkeit aller Anforderungen haben die Hersteller die Gewissheit, dass das Produkt alle Anforderungen erfüllt und keine Risiken für die Patienten birgt.
- Ein weiterer Vorteil ist, dass die Hersteller rasch auf Probleme oder Mängel des Produkts reagieren können. Mithilfe der Dokumentation aller Anforderungen lässt sich schnell identifizieren, wo das Problem liegt und welcher Test damit verknüpft ist. Überdies können sie so die Qualität des Produkts verbessern und die Zufriedenheit der Kunden erhöhen.
- Die Test-Traceability erleichtert außerdem die Compliance mit regulatorischen Vorgaben. Da alle Anforderungen nachvollziehbar und nachweisbar sind, können Hersteller einfacher belegen, dass sie alle Maßgaben der MDR erfüllen und somit ihre Compliance sicherstellen.
- Die Test-Traceability eignet sich auch für die Test-Planung – ergänzend zur retrospektiven Überprüfung, ob alle Anforderungen verifiziert wurden.
Welche Anforderungen gelten für die Umsetzung der Test-Traceability?
Diese Anforderungen gehören zu den Voraussetzungen, damit Sie eine Test-Traceability erfolgreich durchführen können:- Dokumentation und Aufzeichnung von Tests: Es sollten detaillierte Aufzeichnungen über die durchgeführten Tests und deren Ergebnisse vorliegen, die während der gesamten Lebensdauer des Produkts aufbewahrt werden müssen.
- Wiederholbarkeit und Reproduzierbarkeit der Tests: Es sollten klare Anforderungen an die Wiederholbarkeit und Reproduzierbarkeit der Tests definiert sein, um sicherzustellen, dass die Ergebnisse verlässlich sind.
- Compliance mit regulatorischen Anforderungen: Es sollten Maßnahmen ergriffen werden, um sicherzustellen, dass die Tests und Test-Traceability den geltenden regulatorischen Anforderungen entsprechen.
- Traceability der Änderungen: Traceability-Maßnahmen und Dokumentation der Produktänderungen sind erforderlich, um sicherzustellen, dass alle Änderungen dokumentiert und genehmigt werden, bevor sie in die Produktion eingeführt werden. Dieser Punkt überschneidet sich mit dem Bereich Change-Management, welches nicht Thema dieses Blogbeitrags ist.
Es ist wichtig, die Test-Traceability regelmäßig zu überprüfen und zu aktualisieren. Damit wird sichergestellt, dass die Patientensicherheit gewährleistet bleibt und regulatorische Anforderungen erfüllt werden.
Wie können Hersteller die Test-Traceability erstellen?
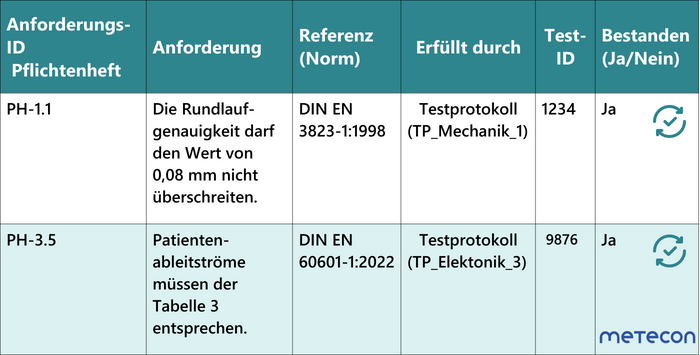
Im ersten Schritt der Produktentwicklung werden die Anforderungen der verschiedenen Stakeholder definiert und im Lasten- und Pflichtenheft aufgeführt. Daneben entwickeln sich aus dem parallel laufenden Risikomanagement weitere Anforderungen an die Sicherheit des Produkts. So entsteht schließlich eine breite Palette an Anforderungen für die Bereiche Elektronik, Mechanik, Software, Produktion und viele mehr.Im nächsten Schritt geht es darum, die Umsetzung der Anforderungen zu verifizieren. Mit der Test-Traceability stellen Sie sicher, dass alle Anforderungen getestet wurden. Die Traceability-Matrix visualisiert diese Beziehungen zwischen den Anforderungen und Tests des Entwicklungsprozesses in Form einer Tabelle. Am einfachsten ist es, eine "Requirement Traceability Matrix" (RTM) als Excel- oder Word-Dokument zu erstellen. Darin können die folgenden Inhalte miteinander in Beziehung gesetzt werden:- die zu verfolgenden Anforderungen mit ihrer ID: z. B. Funktionsanforderungen, Leistungsanforderungen, Sicherheitsanforderungen;
- die Elemente des Systems oder Produkts, die diese Anforderungen erfüllen: z. B. Funktionsmodule, Komponenten, Testprotokolle;
- die Beziehungen zwischen den Anforderungen und den System-/Produkt-Elementen. z. B. "erfüllt durch", "überprüft durch";
- den Teststatus: "bestanden", "nicht bestanden" oder "in Bearbeitung".
- Vorwärts-Traceability
- Rückwärts-Traceability
- F+R-Traceability
 Eine weitere Möglichkeit sind Matrices, in der "nur" die Anforderungen und Test-ID dargestellt werden (Tabelle 2). Hiermit lässt sich leicht prüfen, ob jede Anforderung mit einem Test verifiziert wurde. Allerdings enthält sie keine Informationen, woher die Anforderung kommt.Tabelle 2 Traceability-Matrix mit Anforderung und Testfall
Eine weitere Möglichkeit sind Matrices, in der "nur" die Anforderungen und Test-ID dargestellt werden (Tabelle 2). Hiermit lässt sich leicht prüfen, ob jede Anforderung mit einem Test verifiziert wurde. Allerdings enthält sie keine Informationen, woher die Anforderung kommt.Tabelle 2 Traceability-Matrix mit Anforderung und Testfall Bei RTM mit größeren Datensätzen können Word- oder Excel-Dokumente sehr aufwändig und unübersichtlich werden. In diesen Fällen bieten sich verschiedene Software-Lösungen an.
Bei RTM mit größeren Datensätzen können Word- oder Excel-Dokumente sehr aufwändig und unübersichtlich werden. In diesen Fällen bieten sich verschiedene Software-Lösungen an.Fazit
Die Test-Traceability ist ein wichtiger Bestandteil des Design Control und des Qualitätsmanagements von Medizinprodukten. Sie ermöglicht es, die Anforderungen an das Produkt zu identifizieren, zu verfolgen und damit ihre Erfüllung sicherzustellen. Außerdem lässt sie sich gut für die Testplanung einsetzen. Eine regelmäßige Überprüfung und Aktualisierung der Test-Traceability ist wichtig. So haben Sie als Hersteller die Gewissheit, dass Sie die regulatorischen Anforderungen erfüllen und die Patientensicherheit Ihrer Produkte gewährleistet bleibt.Haben Sie Fragen zur praktischen Umsetzung der Test-Traceability bei Ihren Medizinprodukten? Wünschen Sie sich Unterstützung bei der Erstellung einer Test-Traceability-Matrix? Oder interessiert Sie ein anderer Aspekt der Verifikation und Validierung wie das Change-Management? Kommen Sie gerne auf uns zu. Gemeinsam finden wir die beste Lösung für Ihr Anliegen.Herzliche Grüße
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.



