Klinische Bewertung und PMCF: Update und klinische Nachbeobachtung nach dem Inverkehrbringen
05.12.2022
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
Wer die Klinische Bewertung zu seinen Medizinprodukten bereits nach den Vorgaben der Medical Device Regulation (MDR) (EU) 2017/745 erstellt hat, weiß, wie mühsam das ist. Auch das Zusammenspiel zwischen Klinischer Bewertung und Post-Market Clinical Follow-Up (PMCF; klinische Nachbeobachtung nach dem Inverkehrbringen) stellt viele Hersteller vor neue Herausforderungen. Bianca Reiser und Marie-Laure Castelain aus unserem Clinical Affairs-Team haben sich daher der Aufgabe gestellt, einen pragmatischen Weg für die Aktualisierung der Klinischen Bewertung zu finden. Ihre Ergebnisse in Bezug auf Ihre Klinischen Bewertungen sowie deren Aktualisierung präsentieren sie Ihnen nachfolgend.
Die Tabelle zeigt, welche Aktualisierungsfrequenzen für die relevanten Dokumente gemäß MDR zu beachten sind:Für größere Ansicht Grafik anklicken
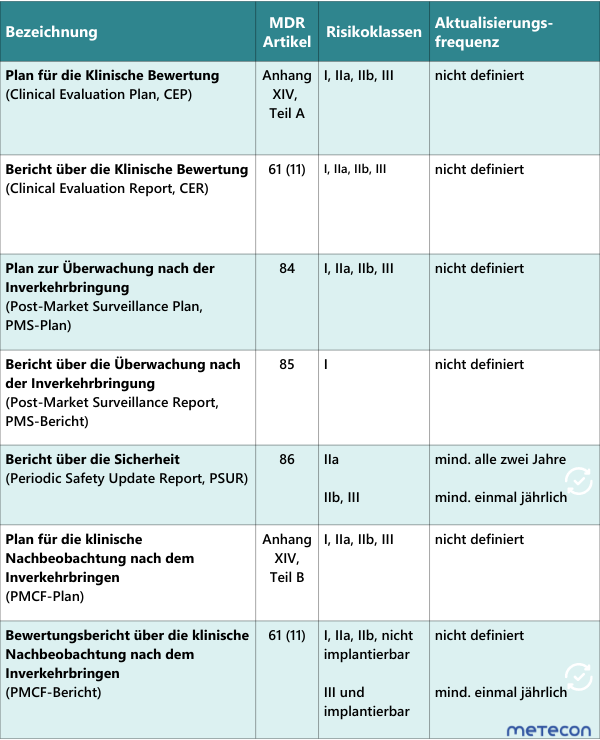
Ebenso sind die Fristen der MEDDEV2.7/1 Revision 4 zu beachten (siehe Kapitel 6.2.3).Wie der Tabelle zu entnehmen ist, sind nur wenige Aktualisierungsfrequenzen in der MDR definiert. Die MDR gibt weder für die Pläne noch für die Überarbeitungsintervalle des klinischen Bewertungsberichts Zeitvorgaben an. Es obliegt Ihnen als Hersteller, eine geeignete Aktualisierungsfrequenz für Ihr Medizinprodukt zu definieren.Unsere Empfehlung: Treffen Sie die Entscheidung über die Aktualisierung des PMCF-Plans auf Basis der Klinischen Bewertung. In der Klinischen Bewertung wird beurteilt, ob die bestehenden PMCF-Aktivitäten ausreichend sind und weitergeführt werden oder nicht. Besteht keine Notwendigkeit für eine Änderung, kann die bisherige PMCF-Strategie weitergeführt werden. Eine Aktualisierung des PMCF-Plans ist in diesem Fall nicht erforderlich.In welchen Abständen der PMCF-Bericht geschrieben wird, ist, mit Ausnahme der Klasse III-Produkte sowie bei Implantaten, ebenfalls nicht vorgegeben. Auch hier liegt es an Ihnen als Hersteller, eine geeignete Aktualisierungsfrequenz zu definieren.
Herzliche Grüße
 Marie-Laure Castelain
Marie-Laure Castelain
 Bianca Reiser
Bianca Reiser
Welche Aufgaben gehören zu PMCF?
Im Rahmen der klinischen Nachbeobachtung können verschiedene PMCF-Aktivitäten durchgeführt werden. Zu diesen Aktivitäten zählen neben der klinischen Studie u. a. Marktumfragen und Literaturrecherchen.Unserer Erfahrung nach sollte Ihr PMCF mindestens eine Literaturrecherche beinhalten. In der Theorie wird die erste Literaturrecherche vor der Zulassung des Produkts im Rahmen der initialen Erstellung der klinischen Bewertung erstellt. Nach dem Markteintritt wird die Recherche im PMCF weitergeführt, und die Klinische Bewertung wird dadurch aktualisiert. Vor Inkrafttreten der MDR (unter MDD) haben Hersteller in der Regel kein "offizielles" PMCF geplant und den klinischen Evaluierungsreport (CER) direkt mit einer Literatursuche aktualisiert. Hier stimmen Sie uns sicher zu: Das Ergebnis bleibt inhaltlich gleich, egal ob die Literatursuche im PMCF oder direkt in der Klinischen Bewertung aktualisiert wird. Der Unterschied liegt darin, dass die Durchführung und Aktualisierung der Literaturrecherche im PMCF die aktuellen MDR-Prozesse regulatorisch reflektiert.Wichtig ist hier: Sie müssen keine zwei verschiedenen Literaturrecherchen (eine im CER und eine im PMCF) durchführen!Beachten Sie, dass die PMCF-Literaturrecherche ebenfalls der MEDDEV 2.7/1 Revision 4 folgen muss, sofern diese der Aktualisierung der Klinischen Bewertung dient. Und die Personen, die diese Literatursuche durchführen, müssen entsprechend qualifiziert sein (siehe Kapitel 6.4 der MEDDEV2.7/1 Revision 4).Welche Auswertungen liegen im PMCF?
Vergessen Sie nicht, einen PMCF-Bericht zu erstellen, nachdem Sie Ihre PMCF-Aktivitäten geplant haben. Für die Erstellung der Inhalte des PMCF-Berichts gibt Ihnen die MDCG 2020-8 eine wegweisende Richtung vor.Laut MDCG 2020-8 beinhalten Teil A "Manufacturer contact details" und Teil B "Medical Device description and specification" des PMCF-Berichts die gleichen Inhalte wie der PMCF-Plan (siehe MDCG 2020-7). Für diese Informationen ist, aus unserer Sicht, ein Verweis auf den Plan ausreichend.Gemäß MDCG 2020-8 sind in Teil C "Activities undertaken related to PMCF: results" die Ergebnisse aus den PMCF-Aktivitäten darzustellen. Wenn Sie Einzelberichte für die jeweiligen Aktivitäten schreiben (z. B. bei einer klinischen Studie), besteht die Gefahr der Redundanz. In diesem Fall reicht in Teil C Ihres PMCF-Berichts eine Referenz auf den jeweiligen Einzelbericht mit einer kurzen Zusammenfassung aus, sofern folgende Aspekte enthalten sind: Qualität der Daten, Begründung von Abweichung(en) vom Plan und eine generelle Analyse der Ergebnisse.Was beinhaltet die Klinische Bewertung?
Der klinische Evaluierungsreport (CER, Clinical Evaluation Report) ist das Hauptdokument der Klinischen Bewertung, welches die klinische Evidenz abbildet. Ausschließlich im CER kann ein fortgesetztes positives Nutzen-Risiko-Verhältnis bestätigt werden. Ein PMCF-Bericht enthält immer nur die Daten, die seit dem letzten PMCF-Bericht neu hinzugekommen sind. Die Gesamtanalyse aller klinischen Daten über den gesamten Produktlebenszyklus eines Medizinprodukts erfolgt daher im CER.Updates von Klinischen Bewertungen schlank halten
Der Aufwand der Aktualisierung wird oft unterschätzt. Jedoch helfen eine gute Koordination und Kommunikation zwischen den beteiligten Abteilungen, um die Effizienz sicherzustellen. Die Klinische Bewertung ist gemäß den Vorgaben der MDR regelmäßig mit den erhobenen klinischen Daten aus dem PMS (Post-Market Surveillance) und PMCF zu aktualisieren. Hierbei werden neue klinische Daten integriert und überprüft, ob das Produkt weiterhin den relevanten Leistungs- und Sicherheitsanforderungen genügt, und das bestehende Nutzen-Risiko-Verhältnis bestehen bleibt.Im Rahmen der Klinischen Bewertung sind auch potenzielle Änderungen der Gebrauchsanweisung, des Risikomanagements und der Marketingdokumente auf Grundlage der gesamten klinischen Evidenz zu prüfen. Je nach Ergebnis der PMS/PMCF-Daten und der potenziellen Änderungen wird eine Anpassung des klinischen Evaluierungsplans (CEP, Clinical Evaluation Plan) notwendig.Gemäß Kapitel 11 der MEDDEV2.7/1 Revision 4 sollte der CER genügend Information beinhalten, um von Dritten, wie der Benannten Stelle, verstanden zu werden. Dazu müssen ausreichend Informationen aus den relevanten Berichten im CER vorhanden sein. Achten Sie darauf, Übertragungsfehler zwischen den Dokumenten zu vermeiden. Copy/Paste der wichtigsten Aussagen kann hier die schnellste und effizienteste Wahl sein. Um Redundanzen zu vermeiden, empfehlen wir: Kopieren Sie ausschließlich die für den CER notwendigen Teile zum Gesamtverständnis und verweisen Sie auf die relevanten Reports (z. B. PMCF-Report).Hinterfragen Sie an dieser Stelle grundsätzlich kritisch: Sind alle Verbesserungen an Ihren Dokumenten notwendig? Perfektion ist nicht immer zielführend (Stichwort: Zeitaufwand), und kann zulasten der Verständlichkeit Ihrer Dokumente gehen.Welche Dokumente müssen aktualisiert werden und wann?
Während des gesamten Produktlebenszyklus müssen verschiedene Dokumente regelmäßig aktualisiert werden. Dies betrifft auch die Dokumente der Klinischen Bewertung und des PMCFs.Die Tabelle zeigt, welche Aktualisierungsfrequenzen für die relevanten Dokumente gemäß MDR zu beachten sind:Für größere Ansicht Grafik anklicken

Ebenso sind die Fristen der MEDDEV2.7/1 Revision 4 zu beachten (siehe Kapitel 6.2.3).Wie der Tabelle zu entnehmen ist, sind nur wenige Aktualisierungsfrequenzen in der MDR definiert. Die MDR gibt weder für die Pläne noch für die Überarbeitungsintervalle des klinischen Bewertungsberichts Zeitvorgaben an. Es obliegt Ihnen als Hersteller, eine geeignete Aktualisierungsfrequenz für Ihr Medizinprodukt zu definieren.Unsere Empfehlung: Treffen Sie die Entscheidung über die Aktualisierung des PMCF-Plans auf Basis der Klinischen Bewertung. In der Klinischen Bewertung wird beurteilt, ob die bestehenden PMCF-Aktivitäten ausreichend sind und weitergeführt werden oder nicht. Besteht keine Notwendigkeit für eine Änderung, kann die bisherige PMCF-Strategie weitergeführt werden. Eine Aktualisierung des PMCF-Plans ist in diesem Fall nicht erforderlich.In welchen Abständen der PMCF-Bericht geschrieben wird, ist, mit Ausnahme der Klasse III-Produkte sowie bei Implantaten, ebenfalls nicht vorgegeben. Auch hier liegt es an Ihnen als Hersteller, eine geeignete Aktualisierungsfrequenz zu definieren.
Fazit
Orientieren Sie sich für die Aktualisierungsfrequenz Ihrer Literaturrecherche an den zeitlichen Vorgaben der PMS-/PSUR-Berichte. Je nach Definition im PMCF-Plan unterliegen andere PMCF-Aktivitäten (z. B. mehrjährig angelegte Studie) davon abweichenden Zeiträumen. PMS-Bericht bzw. PSUR und PMCF-Bericht sollten vor dem geplanten CER-Update vorliegen. Halten Sie die Zeitspanne zwischen den Berichten möglichst kurz, um sicherzustellen, dass die im CER verwendeten Daten nicht veraltet sind.Wir wissen, dass die Umsetzung nicht immer leicht ist, da es die Zusammenarbeit mehrerer Abteilungen erfordert. Gerne helfen wir Ihnen dabei, eine passende Lösung für Ihr PMCF zu finden.Unsere IVD-Spezialist*innen haben für Sie bereits Empfehlungen zur Umsetzung gemäß IVDR in einem Blogbeitrag veranschaulicht.Wir unterstützen Sie gerne in allen Fragen rund um Ihre Klinische Bewertung sowie PMCF. Auch wenn Sie Fragen zu anderen Clinical Affairs-Bereichen haben, ist unser Team für Sie da. Unsere Erstgespräche sind unverbindlich und kostenfrei, so dass Sie kein Risiko eingehen. Wir freuen uns darauf, Sie kennenzulernen!Herzliche Grüße
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.

Medical Device Expert
Clinical Affairs & PMCF

Medical Device Expert
Clinical Affairs & PMCF


